
分析 (1)化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变.
(2)根据相对分子质量为构成分子的各原子的相对原子质量之和,根据高锰酸钾的质量结合方程式求解氧气的质量.
(3)化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变.
解答 解:(1)由2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2X 可知,反应前钾原子是4个,反应后应该是4个,其中2个包含在2X中,反应前后锰原子都是2个,反应前氧原子是10个,反应后应该是10个,其中2个包含在2X中,反应前氢原子是4个,反应后应该是4个,其中2个包含在2X中,因此反应Ⅰ中,X的化学式为KOH.
故填:KOH.
(2)高锰酸钾的相对分子质量为39+55+16×4=158.
设生成氧气的质量为x,
2KMnO4 $\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
316 32
15.8g x
$\frac{316}{15.8g}=\frac{32}{x}$,
x=1.6g,
答:反应生成氧气的质量是1.6g.
故答案为:158;1.6;
(3)①加热时,高锰酸钾中的钾、锰元素不能转化为氧元素;
②加热时,如果K2MnO4进一步分解并释放出氧气时,会导致产生的氧气质量偏大;
③如果加热温度不同时,高锰酸钾不按“反应Ⅱ”分解,可能会导致产生氧气的质量偏大;
因此肯定错误的是①,理由是化学反应前后,元素种类不变.
故填:①;化学反应前后,元素种类不变.
点评 本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:初中化学 来源: 题型:选择题
| A. | 证明铜比银活泼:Cu+2AgCl═CuCl2+2Ag | |
| B. | 酸雨的形成原理:CO2+H2O═H2CO3 | |
| C. | 盐酸除铁锈(Fe2O3•nH2O):Fe2O3•nH2O+6HCl═2FeCl3+(n+3)H2O | |
| D. | 除去H2中混有的HCl气体:Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一种原子只能构成一种分子 | |
| B. | 质子数相等的粒子一定属于同种元素 | |
| C. | 原子得失电子形成离子时,其电子层数可能有变化 | |
| D. | 同种元素的粒子,其核外电子数一定相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 乙醇的分子结构模型如图所示,则下列叙述不正确的是( )
乙醇的分子结构模型如图所示,则下列叙述不正确的是( )| A. | 乙醇是由三种元素组成的化合物 | B. | 一个乙醇分子中含有26个质子 | ||
| C. | 乙醇中碳、氧元素的质量比为2:1 | D. | 乙醇中碳元素的质量分数最大 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
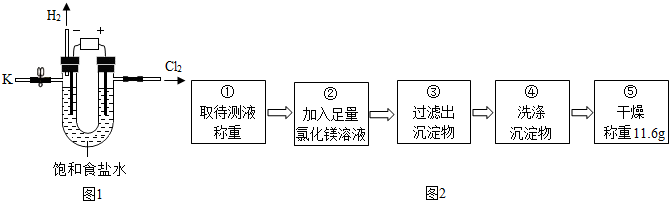
| 实验步骤 | 实验现象 | 实验结论 |
| 向待测液中滴加几滴酚酞试液 | 酚酞试液变红色 | 待测液呈碱性,说明含有氢氧化钠. |
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 | 11 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 | 2.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com