为检验当地石灰石中碳酸钙的质量分数,他在实验室用6克该石灰石样品与19克稀盐酸恰好完全反应,测得残留物为22.8克.(杂质既不溶于水,也不与盐酸反应).
(1)根据质量守恒定律,生成二氧化碳的质量为______ 克.
(2)样品中碳酸钙的质量分数.
(3)所用稀盐酸中溶质的质量分数.
(4)所得溶液中溶质的质量分数.
解:(1)依据质量守恒可知,之所以残留物的质量减轻,是由于产生了气体,因此减轻的质量就是CO
2的质量:m(CO
2)=(6+19-22.8)g=2.2g;
(2)设要想生成2.2g二氧化碳,需要参加反应的碳酸钙质量为x,参加反应的氯化氢质量为y,生成氯化钙的质量是z
CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑
100 73 111 44
x y z 2.2g
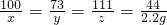
解得x=5g;y=3.65g;z=5.55g
样品中碳酸钙的质量分数为
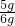
×100%=83.3%.
(3)所用稀盐酸中溶质的质量分数=
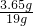
×100%=19.2%.
(4)由以上的分析知该样品中杂质的质量是6g-5g=1g,故所得溶液的质量是22.8g-1g=21.8g,则所得溶液中溶质的质量分数为
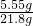
×100%=25.5%.
故答案为:(1)2.2;(2)样品中碳酸钙的质量分数为83.3%.(3)所用稀盐酸中溶质的质量分数为19.2%;(4)所得溶液中溶质的质量分数为25.5%.
分析:(1)依据质量守恒可知,之所以残留物的质量减轻,是由于产生了气体,因此减轻的质量就是CO
2的质量;
(2)根据二氧化碳的质量,计算出碳酸钙的质量,再用碳酸钙的质量除以6g乘以百分之百算出;
(3)根据二氧化碳的质量,计算出氯化氢的质量,再用氯化氢的质量除以19g乘以百分之百算出.
(4)根据二氧化碳的质量,计算出生成的氯化钙质量,再利用残留物与杂质的质量之差求出溶液的质量,即可得得溶液中溶质的质量分数.
点评:解答本题的关键是根据质量守恒定律,推出质量的减少量就是二氧化碳的质量,再根据二氧化碳的质量算出,参加反应碳酸钙、氯化氢的质量以及生成的氯化钙质量;

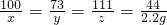
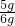 ×100%=83.3%.
×100%=83.3%.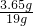 ×100%=19.2%.
×100%=19.2%.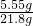 ×100%=25.5%.
×100%=25.5%.

 全优点练单元计划系列答案
全优点练单元计划系列答案