
【题目】波尔多液的制备及组成测定波尔多液是常见的杀菌剂,为天蓝色碱性悬浊液。以硫酸铜、生石灰及水为原料,制备波尔多液。为测定从波尔多液中分离出的天蓝色固体[CuSO4aCu(OH)2bCa(OH)2cH2O]的组成,设计如下实验:
(实验)称取64.4g天蓝色固体,加入足量稀HNO3使其完全溶解,再加入过量Ba(NO3)2溶液,过滤,洗涤干燥得白色固体23.3g。
(1)判断Ba(NO3)2溶液已过量的方法是:静置,向上层清液中滴加______溶液,无现象。
(2)不能在铁制容器中配波尔多液。请用化学方程式解释原因______。
(实验Ⅱ)另取64.4g天蓝色固体,用如图装置进行热分解实验
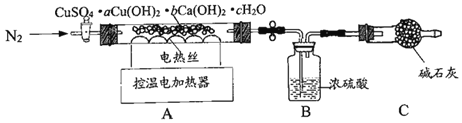
(资料)①CuSO4、Cu(OH)2、Ca(OH)2在一定温度下能受热分解,分别生成两种氧化物,分解过程中各元素的化合价均不改变。
②天蓝色固体在110℃时,完全失去结晶水。
③Cu(OH)2在100℃时分解完全。CuSO4和Ca(OH)2在580℃左右时开始分解,到650℃时均能分解完全。
④浓硫酸可用于吸收SO3。
(3)按图连接好装置,实验前要先______。
(4)控制温度在110℃充分加热,测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2g。最终剩余固体中的成分是______。
(5)整个加热过程中,天蓝色固体分解生成水的总质量为______g。
(6)天蓝色固体CuSO4aCu(OH)2bCa(OH)2cH2O中,a:b:c=______。
【答案】硝酸钡 Fe+CuSO4=FeSO4+Cu 检查装置的气密性 CuO和CaO 18 1:4:5
【解析】
(1)判断Ba(NO3)2溶液已过量就是检验硫酸根离子无剩余,所以对应的方法是:静置,向上层清液中滴加硝酸钡溶液,无现象。
(2)不能在铁制容器中配波尔多液。是因为铁和硫酸铜反应生成硫酸亚铁和铜,对应的化学方程式为:Fe+CuSO4=FeSO4+Cu。
称取64.4g天蓝色固体,加入足量稀HNO3使其完全溶解,再加入过量Ba(NO3)2溶液,过滤,洗涤干燥得白色固体23.3g,沉淀为硫酸钡,设硫酸铜的质量为x,对应的硫酸铜分解生成的三氧化硫的质量为y,硫酸铜对应的分解产物氧化铜的质量为z。
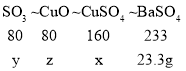
![]()
x=16g
y=8g
z=8g
浓硫酸可用于吸收水和SO3.所以测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2g。整个加热过程中,天蓝色固体分解生成水的总质量为10.8g+15.2g-8g=18g。
Cu(OH)2在100℃时分解完全。CuSO4和Ca(OH)2在580℃左右时开始分解,到650℃时均能分解完全,控制温度在110℃充分加热,测得B装置增重10.8g。再升温至650℃充分加热,B装置又增重了15.2g。最终剩余固体中的成分是 CuO和CaO。
再升温至650℃充分加热,B装置又增重了15.2g,由于其中有吸收的8g三氧化硫,所以生成水的质量为15.2g-8g=7.2g,来自于氢氧化钙的分解,则氢氧化钙的质量为a,对应的氧化钙的质量为b

![]()
a=29.6g
b=22.4g
则氢氧化铜对应的氧化铜的质量为64.4g-10.8g-15.2g-z-b=64.4g-10.8g-15.2g-8g-22.4g=8g
则对应的分解生成的水的质量为c,对应的氢氧化铜的质量为d
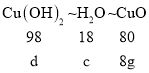
![]()
c=1.8g
d=9.8g
则结晶水的质量为18g-7.2g-1.8g=9g
天蓝色固体CuSO4aCu(OH)2bCa(OH)2cH2O中,a:b:c=![]() :
:![]() :
:![]() =1:4:5
=1:4:5
由于过程中需要准确测定水的质量变化,所以按图连接好装置,实验前要先 检查装置的气密性。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】(1)用化学符号填空:
①1个氧原子_____;②氯酸钾中氯的化合价_____;
③2个铁离子_____;④地壳含量最多的金属元素的氧化物_____.
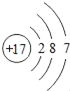
(2)如图是某元素的原子结构示意图,该原子核外有_____个电子层,在化学反应中容易_____电子(填“得”或“失”),所形成微粒的符号是_____,该微粒与铜离子形成化合物的化学式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下表回答问题。
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)上表中的三种物质在20℃时,___________的溶解度最大;
(2)将40 ℃时NH4Cl和NaCl的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:NaCl_____NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3 溶液中混有少量的NaCl,要得到KNO3 晶体的方法是_______。
(4)A是80℃含有120 g水的KNO3溶液。经过如下操作,得到102 gKNO3固体。
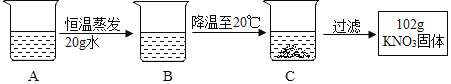
对以上过程的分析,正确的是__________(选填编号)。
① A到B的过程中,溶质质量没有改变
② B中溶质与溶剂的质量比为 169:100
③ 开始析出KNO3固体的温度在60℃至80℃之间
④ A溶液的质量等于222 g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是实验室制取气体的常用仪器,回答下列问题。

(1)标号为a的仪器名称是__________;
(2)用大理石和稀盐酸反应制取CO2,并用排水法收集。
①该反应的化学方程式为__________;
②若要制取两瓶CO2(总质量为4.4g),所用7.3%的盐酸至少__________g;
③组装制取装置时,需选择上图中的a、b、h、i、k、l、m和_________;
④实验室制取下列气体时,可选用制取二氧化碳装置的是_________(填序号)
A 锌粒和稀硫酸制取氢气
B 加热无水醋酸钠与碱石灰固体制取甲烷
C 硫化亚铁与稀硫酸常温反应制取易溶于水的硫化氢气体
(3)实验室用KClO3制取O2:
①若用排水法收集O2,当观察到_________现象时,说明已收集满。
②反应过程中MnO2在固体混合物中质量分数变化情况,正确的是_________(填序号)
A 先逐渐变小,最后不变 B先逐渐变大,最后不变 C 始终不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】MgSO4和Na2SO4的浴解度表及溶解度曲线如图。下列说法正确的是 ( )
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | |
溶解度 S/g | MgSO4 | 33.7 | 38.9 | 44.5 | 50.6 | 54.6 | 55.8 |
Na2SO4 | 19.5 | 40.8 | 48.8 | 47.5 | 45.3 | 44.8 | |
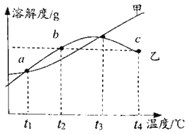
A. 甲为Na2SO4
B. 应介于40℃-50℃之间
C. 乙的饱和溶液,降温到的过程中,一直有晶体析出
D. b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】清华大学研究人员成功研出一种纳米纤维催化剂,可将二氧化碳催化转化成液体燃料甲醇,下图为该反应的微观模拟示意图(图中微粒恰好完全反应)。下列有关说法正确的是( )
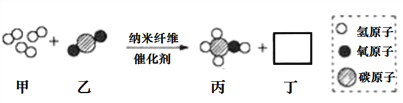
A. 该反应类型为复分解反应
B. 参加反应的甲、乙质量之比为3:1
C. 生成物丙和丁均为氧化物
D. 该反应实现了无机物到有机物的转化
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分析推理是一种重要的化学思维方法,以下推理正确的是( )
A. 置换反应有单质和化合物生成,则有单质和化合物生成的反应都是置换反应
B. 化合物是由两种或两种以上元素组成的物质,则由两种或两种以上元素组成的物质一定是化合物
C. 点燃可燃性气体前要验纯,所以点燃H2前一定要验纯
D. 通常情况下,pH<7的溶液呈酸性,则pH<7的雨水是酸雨
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请沿用科学家认识事物的方式认识“空气”。
(1)从分类角度:空气属于______(填“混合物”或“纯净物”)。
(2)从变化角度:已知:常压下,氮气沸点-196℃,氧气沸点-183℃。常温下将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是_____。将该烧杯放置一段时间后,液态物质剩余约1/10体积,其主要成分是_____。
(3)从应用角度:利用空气制取氮肥的流程如图所示。
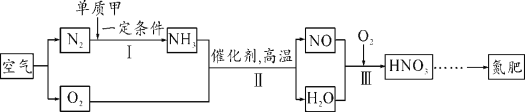
①Ⅰ中参加反应的单质甲为_____。
②Ⅱ中反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H 为初中化学常见的物质,它们之间的转化关系如图所示(部分生成物已略去)。已知 A、B 是组成元素相同的两种物质,D 是一种固体单质,H 是蓝色沉淀。请按要求回答下列问题:
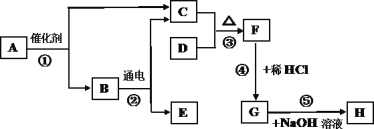
(1)A的化学式是______,F 的化学式是_____。
(2)反应②产生的 C 和 E 的体积比约为______。
(3)写出反应⑤的化学方程式______。
(4)写出D的一种用途______(任写一种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com