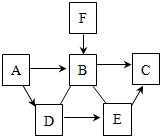
��2012?���ţ���֪A��B��C��D��E��F�dz��л�ѧ�г������������ʣ�����֮����һ������������ͼ��ʾ��ת����ϵ��ͼ�С�������ʾ���ʼ����ת����ϵ����-����ʾ������Һ���ܷ�����Ӧ������֪A��B��D����������Ԫ����ɣ���A��B����Ԫ�ظ�����ͬ��C��E��������Ԫ�أ�����E��������������������F��һ����ά��������ĵ��ʣ�ͨ��״̬��Ϊ���壩���밴Ҫ��ش��������⣺
��1���F������
����
����
��E������
��ʯ�ң�����ʯ�ң�
��ʯ�ң�����ʯ�ң�
��A�Ļ�ѧʽ
HCl
HCl
��
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��
��B---D��
CO2+H2O=H2CO3
CO2+H2O=H2CO3
��������C���ҷ�Ӧ��Ϊ�����εĸ��ֽⷴӦ��
Na2CO3+CaCl2=CaCO3��+2NaCl
Na2CO3+CaCl2=CaCO3��+2NaCl
��
��3��A��D����ͨ��A�ֱ���
��
��
�ֲ�ͬ���͵����ʷ�Ӧ��ʵ�֣�
��4����B���Ԫ����ͬ����һ�����ʵĻ�ԭ���ڹ�ҵ������Ҫ��;����д��һ����ѧ����ʽ���Ա�ʾ
��

 ��2012?���ţ���֪A��B��C��D��E��F�dz��л�ѧ�г������������ʣ�����֮����һ������������ͼ��ʾ��ת����ϵ��ͼ�С�������ʾ���ʼ����ת����ϵ����-����ʾ������Һ���ܷ�����Ӧ������֪A��B��D����������Ԫ����ɣ���A��B����Ԫ�ظ�����ͬ��C��E��������Ԫ�أ�����E��������������������F��һ����ά��������ĵ��ʣ�ͨ��״̬��Ϊ���壩���밴Ҫ��ش��������⣺
��2012?���ţ���֪A��B��C��D��E��F�dz��л�ѧ�г������������ʣ�����֮����һ������������ͼ��ʾ��ת����ϵ��ͼ�С�������ʾ���ʼ����ת����ϵ����-����ʾ������Һ���ܷ�����Ӧ������֪A��B��D����������Ԫ����ɣ���A��B����Ԫ�ظ�����ͬ��C��E��������Ԫ�أ�����E��������������������F��һ����ά��������ĵ��ʣ�ͨ��״̬��Ϊ���壩���밴Ҫ��ش��������⣺

