
����Ŀ���Ȼ���(NaCl) ������� (KNO3) �ڲ�ͬ�¶�ʱ���ܽ�ȼ����ܽ���������£�
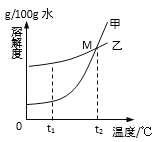
�¶ȣ��棩 | 10 | 20 | 40 | 60 | 80 |
KNO3 | 20.9 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.8 | 36 | 36.6 | 37.3 | 38.4 |
��ͼ���ܱ�ʾKNO3�ܽ�����ߵ���___����ס����ҡ�����
��������M������_______��
��Ҫ����100g 10%��KNO3��Һ����ҪKNO3����________g��
��t1oCʱ���������ļ��Ҷ������ʷֱ��ˮ�Ƴ���Ӧ�ı�����Һ���õ���Һ�����ϴ����_______����ס����ҡ�����
��20��ʱ���������ֱ�ʢ����ͬ����������غ��Ȼ��Ƶ��ձ��У�������100gˮ������ܽ�ָ���20�棬������ͼ��ʾ��
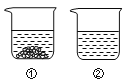
�����й�˵���У���ȷ����________��������ĸ��ţ�
A���ձ������ܽ����KNO3���ձ������ܽ����NaCl
B���ձ�������Һһ���Dz�������Һ
C�������¶Ȼ������ܼ����п��ܽ��ձ����й���ȫ���ܽ�
D�������ձ����е���Һ��Ϊ��������Һ����Һ��������������һ����С
���𰸡� �� t2oCʱ���ҵ��ܽ����� 10 �� A C
��������(1). �ɱ��������ݿ�֪������ص��ܽ�����¶�Ӱ��ϴ������ܱ�ʾKNO3�ܽ�����ߵ��Ǽ� (2). ���ܽ������ͼ�ϣ����������¶ȣ����������ܽ�ȡ���������M��ĺ�����t2oCʱ���ҵ��ܽ����� (3). ����100g 10%��KNO3��Һ����ҪKNO3��������Ϊ�� 100g��10%=10g (4). ���ܽ����һ���¶��£�100g�ܼ���ﵽ����ʱ�����ܽ�����ʵ�������t1oCʱ���ҵ��ܽ�ȱȼĴ������ļ��Ҷ������ʷֱ��ˮ�Ƴ���Ӧ�ı�����Һ���õ���Һ�����ϴ���Ǽ� (5).A 20��ʱ���Ȼ��Ƶ��ܽ�ȱ�����صĴ�����ˮ������ر��Ȼ����ܽ���٣��ձ������ܽ����KNO3���ձ������ܽ����NaCl��B���ձ�������Һ�����Dz�������Һ��Ҳ���ܸպñ��ͣ�C�������¶Ȼ������ܼ���������������ܽ�������¶����ߵ�һ���̶ȣ������һ�������ܼ����ܽ��ձ����й���ȫ���ܽ⣻


 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016�����ʡ��ɳ�С����й������˵��������ǣ� ��
A��Ũ���������ˮ�ԣ�Ũ������лӷ���
B��ϡ�����ϡ���ᶼ�����ڽ�������
C��ϡ�����ܹ�ʹ��ɫʯ����Һ����ɫ��̪��Һ�����ɫ
D��ϡ�����ܹ�����ý�����Ӧ��ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2015��ɽ��ʡ�����С������ǻ�ѧѧϰ���о�����Ҫ���������������У����ڻ������ǣ� ��
A������� B��ʯ��ˮ C��������̼ D����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016�����ʡ�����С�������Ҫ�ֲ��ھ����10��50km�ĸ߿գ��������մ������ߣ�������������������ڣ� ��
A������ B������� C�������� D��ϡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ���������������Ҫ�����á�
�ٸ�װǰ�ġ����������⼣�߰ߣ���ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽΪ__________��
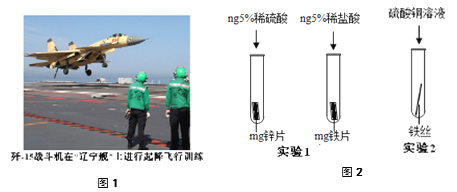
��Ϊ�����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ�Ľ�����С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2��ʾ������ʵ�飺
��.ʵ��1�У�С���ԡ���������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ��������������__________��
��.ͨ��ʵ��2����֤�����Ļ�Ա�ͭǿ����Ӧ�Ļ�ѧ����ʽ��__________��
��ij��Ƴ��ŷŵ���ˮ�к���CuSO4��ZnSO4��FeSO4��Ϊ����ˮ��Ⱦ����Լ�ɱ���������Ҫ��������п���йؽ��������������ʾ���̡�
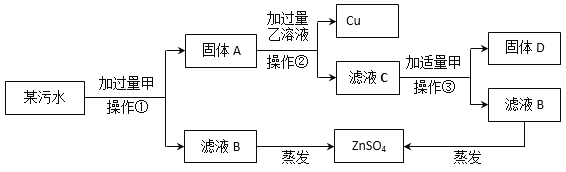
������������ͼ�жϸû��������У�����A�ijɷ���__________��
����Ԫ�ص����ʣ���ˮ���⣩��__________������ĸ���A��B��C��D����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԷ��ӡ�ԭ�ӡ����ӵ���ʶ��ȷ����
A���¶�Խ�ߣ������˶�����Խ��
B��ԭ������С�����ӣ������ٷ�
C�����Ӳ���ֱ�ӹ�������
D��������ѹ����˵��������Ӽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͥ��������һ����ѧС���磬�������Ų��ٻ�ѧ֪ʶ��
����Ȼ������Ҫ�ɷ��Ǽ��飨CH4������������________��ѡ�����л������������
����ȼ�յĻ�ѧ����ʽ��___________��0.2mol���������Լ��________��̼ԭ�ӡ�
������ʱ��ʳ�ν���ú�������ϣ������___ɫ��ÿ��ÿ��ʳ���������������6g���£�
��ij������ʳ��5.85g��������ʳ�ε����ʵ���Ϊ____mol��
��ͨ������ζ�ķ������������Ͼƺ�ʳ�ף��÷�����Ҫ�����˷��Ӿ���_____________�����ʡ�
��������װ��ˮ�����������ֱ��ˮ����ˮ���л���̿����____��ֱ��ˮΪ_____��ѡ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ּ��߷�չDZ���������Դ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч������Ⱦ�����ⷽ�����䷴Ӧ��������ͼ��ʾ��

��1����ӦI�У�������Ӧ�Ļ�ѧ����ʽΪ_______________��
��2����ӦII�У���Ӧǰ�ϼ۷����ı��Ԫ����______________����Ԫ�����ƣ���
��3����������Ӧ�����У�SO2��H2SO4��I2��HI����ѭ��ʹ�ã����Ƶ�H2����Ԫ�������Դ��______���ѧʽ����
��4����������Ϊ��������ȼ�ϣ���ʵ������98g��������Ϊ20����ϡ����������п��Ӧ��������������������Ƕ���? _______________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com