
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  | 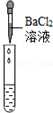 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
分析 【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】(1)根据氢氧化钠和硫酸铜反应生成氢氧化铜沉淀进行分析;
(2)根据碳酸钠和硫酸反应能生成二氧化碳气体进行分析;
【评价反思】①根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中;
②检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀;
③根据酸会与碳酸钠反应生成二氧化碳气体进行分析.
解答 解:【假设猜想】硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量,当氢氧化钠过量时,反应后溶液中的溶质为硫酸钠和氢氧化钠,酸、碱过量,但不能同时过量,因为酸碱不能共存,会继续反应,故猜想四不合理;
【实验探究】(1)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠;
(2)溶液中有硫酸,滴加碳酸钠后,碳酸钠会和硫酸反应生成二氧化碳气体,因此会看到产生气泡;
【评价反思】①根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
②检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;
③取样品于试管中,加入碳酸钠溶液,有气泡产生,说明猜想二成立,化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑.
故答案为:【假设猜想】四,氢氧化钠和硫酸会发生反应;
【实验探究】(1)NaOH;
(2)有气泡产生;
【评价反思】①pH试纸浸入溶液中;
②Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在;
③取样品于试管中,加入碳酸钠溶液,有气泡产生,说明猜想二成立,化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑.
点评 本题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作以及实验方案的评价,解答时要全面审题,认真解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
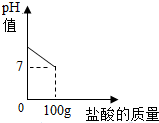 在含氯化钠杂质的纯碱样品12.4g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与溶液的pH值的关系如图所示,计算:
在含氯化钠杂质的纯碱样品12.4g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与溶液的pH值的关系如图所示,计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有燃烧反应才会放出热量 | |
| B. | 浓氢氧化钠溶液沾到手上,马上用大量清水冲洗,然后涂上硼酸溶液 | |
| C. | 生成盐和水的反应一定是中和反应 | |
| D. | 盐中一定含有金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com