
分析 本题可直接利用4.4g的气体即二氧化碳的质量,借助化学方程式来进行相关的计算.根据质量守恒来计算反应后溶液的质量.
解答 解:设样品中含碳酸钙的质量为x,盐酸溶液中含HCl的质量为y,生成氯化钙的质量为z
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 111 44
x y z 4.4g
$\frac{100}{x}=\frac{73}{y}=\frac{111}{z}=\frac{44}{4.4g}$
x=10g;y=7.3g;z=11.1g
则(1)样品中CaCO3的质量分数为$\frac{10g}{12.5g}×100%$═80%;
(2)加入的稀盐酸的质量为:7.3g÷10%=73g;
(3)反应后所得溶液的质量为:10g+73g-4.4g=78.6g,反应后所得溶液溶质的质量分数为:$\frac{11.1g}{76.8g}×100%$=14.5%.
答:(1)样品中CaCO3的质量分数为80%;
(2)加入的稀盐酸的质量为73g;
(3)反应后所得溶液溶质的质量分数为14.5%.
点评 本题较简单,可直接利用化学方程式来计算,但应注意计算格式要规范,向规范要质量.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:解答题
| 温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
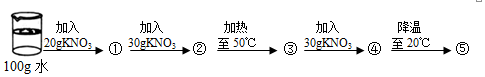
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 浓硫酸(H2SO4)500毫升 | |
| 溶质的质量分数 | 98% |
| 密度 | 1.84克/厘米3 |
| 相对分子质量 | 98 |
| 强腐蚀性,阴冷,密封储藏 | |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 常见元素或原子团 | OH- | SO42- | CO32- | H元素 | Na元素 | Cl元素 | Fe元素 | S元素 |
| 常见化合价 | -1 | -2 | -2 | +1 | +1 | -1、+5、+7 | +2、+3 | -2、+4、+6 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 饱和溶液析出晶体后,溶质的质量分数可能不变 | |
| B. | “冬天捞碱,夏天晒盐”的主要原理是不同物质的溶解度随温度变化不同 | |
| C. | 不饱和溶液转化为饱和溶液,其溶质质量分数一定变大 | |
| D. | 向氯化铁溶液中加入少量生石灰,原溶液中溶质的溶解度和溶质质量分数都发生变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示:
用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com