
回答下列实验仪器和实验操作的有关问题.
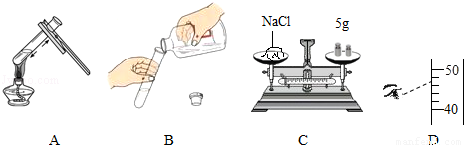
(1)图A中试管夹的作用是 .
(2)指出图B中的错误操作是 .
(3)图C、D是某同学配制50g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况.
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是 ,至天平平衡.
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会 (填“偏大”、“偏小”或“不变”).
(1)夹持试管 (2)瓶塞正放(或瓶塞没有倒放)
(3)①向左盘添加氯化钠 ②偏小
【解析】
试题分析:(1)熟悉在给试管中的物质加热时,试管夹的用途是用来夹持试管的,故答案为:夹持试管;
(2)瓶塞应该倒放在桌面上,以免化学试剂腐蚀桌面或将杂质带入试剂瓶中使试剂不纯,故答案为:瓶塞正放(或瓶塞没有倒放);
(3)①指针偏右说明右盘质量大,左盘质量小,要想使天平平衡,应该向左盘添加氯化钠,故答案为:向左盘添加氯化钠;
②量取水时,仰视读数,所得液体的体积大于实际所需液体的体积,即溶剂的量偏多了,根据溶质质量分数的计算公式可知,溶剂偏多时,所得溶质质量分数偏小,故答案为:偏小.
考点:给试管里的液体加热;称量器-托盘天平;液体药品的取用;一定溶质质量分数的溶液的配制.
点评:此题主要考查了最基本的实验操作问题,有利于培养学生严谨的科学态度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
| 实 验 操 作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加 硝酸银 硝酸银 溶液 |
现象① 有气泡产生 有气泡产生 ;现象② 有白色沉淀生成 有白色沉淀生成 ; |
含有Cl- |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 |
稀硫酸与氢氧化钠溶液能发生反应 |
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若 生成蓝色沉淀 生成蓝色沉淀 |
氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 先用PH试纸测定稀硫酸的PH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的PH. | PH逐渐变大, 最后 PH≥7 | 稀硫酸与氢氧化钠溶液能发生反应 |
| 实 验 步 骤 | 实验现象 | 结论 |
| 稀硫酸与氢氧化钠溶液反应放热 |
| 实验步骤 | 实验现象 | 结论 |
| 取少量上述反应后的溶液于试管中,滴加硫酸铜溶液. | 若______ | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀硫酸与氢氧化钠溶液恰好完全反应 |
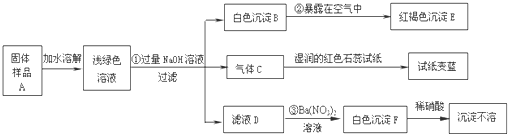
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实 验 操 作 | 实验现象 | 实验结论 |
| ①取样溶解,向样品溶液中滴加过量稀硝酸. ②再向上述所得溶液加______溶液 | 现象①______; 现象②______; | 含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com