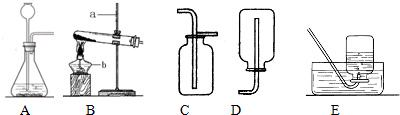
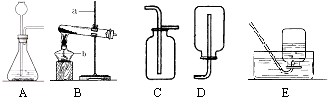
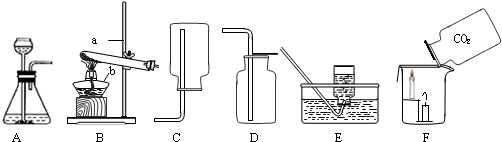
解:(1)依据实验室常用仪器的认识并写出仪器名称,图示a为铁架台,b为酒精灯;
(2)实验室用氯酸钾和二氧化锰混合制取氧气时,该反应原理的化学方程式为:2KClO
3
2KCl+3O
2↑,混入KMnO
4也能加快KClO
3的分解,因为 KMnO
4受热分解产生的MnO
2可作KClO
3的催化剂,起催化作用.
(3)实验室制O
2、CO
2和H
2时,都可选用固态物质和液态物质反应不需加热的发生装置,故选A装置;
(4)如图F所示,向烧杯中“倾倒”二氧化碳,说明二氧化碳的密度比空气的大,下层蜡烛先熄灭,上层蜡烛后熄灭,更进一步说明二氧化碳具有的性质是:不能燃烧,不能支持燃烧,且密度比空气的大;因此,二氧化碳的重要用途之一是可以用来灭火,固态二氧化碳俗称干冰.
(5),同时生成硫酸钠.已知:SO
2是一种没有颜色而有刺激性气味的有毒气体,易溶于水,密度比空气大,常温下在空气中不反应.
①用亚硫酸钠(Na
2SO
3)固体与浓硫酸反应来制取SO
2的化学方程式为 Na
2SO
3+H
2SO
4═Na
2SO
4+SO
2↑+H
2O.
②SO
2易溶于水,密度比空气大,故收集SO
2的装置不能为 CE,用如图所示装置收集二氧化硫时要长进短出.
故答案是:
(1)铁架台;酒精灯.
(2)2KClO
3
2KCl+3O
2↑;KMnO
4受热分解产生的MnO
2可作KClO
3的催化剂(其它合理答案也可,2分).
(3)A.
(4)不燃烧,也不支持燃烧;灭火;干冰.
(5)①Na
2SO
3+H
2SO
4═Na
2SO
4+SO
2↑+H
2O.
②CE;SO
2易溶于水,密度比空气大.
③(如图)

分析:(1)依据实验室常用仪器认识解决此题.
(2)实验室用氯酸钾和二氧化锰混合制取氧气时,选用的是固态物质反应需加热的发生装置;会写该反应原理的化学方程式;知道该反应中二氧化锰做反应条件催化剂起什么作用.
(3)实验室制取O
2、CO
2和H
2时,都选用的是固态物质和液态物质反应不需加热的发生装置;
(4)如图 F 实验向烧杯中“倾倒”二氧化碳,说明二氧化碳的密度比空气的大,下层蜡烛先熄灭,上层蜡烛后熄灭,更进一步说明二氧化碳具有的性质,这样能探究二氧化碳的性质和重要用途.
(5)根据实验室制取二氧化硫的反应原理和二氧化硫的物理性质选择适当的收集方法.
点评:本题考查氧气和二氧化碳实验室制法中实验、收集装置的选取.同时考查它们的反应物状态、反应条件及其作用.使学生进一步明白反应物状态、反应条件与实验装置之间的关系.学会验证二氧化碳气体,探究其性质及用途.

 2KCl+3O2↑,混入KMnO4也能加快KClO3的分解,因为 KMnO4受热分解产生的MnO2可作KClO3的催化剂,起催化作用.
2KCl+3O2↑,混入KMnO4也能加快KClO3的分解,因为 KMnO4受热分解产生的MnO2可作KClO3的催化剂,起催化作用. 2KCl+3O2↑;KMnO4受热分解产生的MnO2可作KClO3的催化剂(其它合理答案也可,2分).
2KCl+3O2↑;KMnO4受热分解产生的MnO2可作KClO3的催化剂(其它合理答案也可,2分).


 一线名师提优试卷系列答案
一线名师提优试卷系列答案