
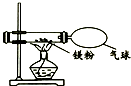
 某兴趣小组为了验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为了验证质量守恒定律,做了镁条在空气中燃烧的实验.| 物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
| 颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
分析 (1)根据镁条在空气中燃烧的化学方程式进行分析.
(2)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.
(3)[查阅资料]根据质量守恒定律确定产物中一定不存在氯化镁;
[提出猜想]根据空气的成分和固体的颜色判断淡黄色固体的来源;
[实验探究]根据在纯氧气中燃烧镁条只生成白色固体,在纯氮气中燃烧镁条只生成淡黄色色固体,可采取在纯纯氮气中燃烧镁条,观察现象的方法;
[相关结论]根据空气的成分及氮气的性质分析回答.
解答 解:(1)在点燃的条件下,镁与氧气反应生成氧化镁,化学方程式为:2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO;
(2)所有的化学变化都遵循质量守恒定律;
(3)[查阅资料]根据质量守恒定律,化学反应前后元素的种类不变,由于空气中无氯元素,所以燃烧产物中一定不存在氯化镁;
[提出猜想]空气中含有氮气,在空气中点燃镁条时,生成的白色固体物质中夹杂着少量的淡黄色固体,而氮化镁为淡黄色,所以淡黄色的固体可能是镁与空气中的氮气反应生成的.镁和氮气在点燃的条件下反应生成氮化镁,化学方程式:3Mg+N2 $\frac{\underline{\;点燃\;}}{\;}$Mg3N2.
[实验探究]由于在纯氧气中燃烧镁条只生成白色固体氧化镁,在纯氮气中燃烧镁条只生成淡黄色色固体氮化镁,可用在纯氮气中燃烧镁条,观察现象的方法.
[相关结论]空气中氮气(N2)和氧气(O2)的体积比约为4:1,但镁条在空气中燃烧只生成少量的淡黄色固体,由此得出的一个结论是氮气含量多但是很稳定,难以发生反应.
故答案为:(1)2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO;
(2)不同意;所有的化学反应都遵循质量守恒定律;
(3)[查阅资料]空气的成分中不含氯元素;
[提出猜想]氮化镁;氮气(或N2);3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
[实验探究]将点燃的镁条伸人充满氮气的集气瓶中,观察是否生成淡黄色的固体
[相关结论]4:1,氮气含量多但是很稳定,难以发生反应.
点评 正确理解质量守恒定律的内容,了解燃烧的定义及定义的拓展意义是解决问题的关键,书写化学方程式一定要确定反应物和生成物的化学式,不要忘记配平和条件.


科目:初中化学 来源: 题型:选择题
| A. | 水是一种最常见的溶剂,自然界中的水都不是纯净物 | |
| B. | 酸雨的形成与大气中SO2等酸性污染物增多有关 | |
| C. | 水中N、P元素的增多会引起水体的富营养化污染,引起赤潮和水华 | |
| D. | pH=0的水溶液,是中性的溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁丝在氧气中燃烧生成黑色固体:4Fe+3O2 $\frac{\underline{\;点燃\;}}{\;}$ 2Fe2O3 | |
| B. | 医疗上用氢氧化镁中和过多胃酸:Mg(OH)2+H2SO4═MgSO4+2H2O | |
| C. | 正常雨水的pH约为5.6的原因:CO2+H2O═H2CO3 | |
| D. | 证明铁是金属活动顺序表中氢之前的金属:2Fe+6HCl═2FeCl3+3H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 已知氯化钠、碳酸钠在不同温度时的溶解度如下:
已知氯化钠、碳酸钠在不同温度时的溶解度如下:| 温度/℃ 溶解度/g | 0 | 10 | 20 | 30 | 40 |
| 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
| 碳酸钠 | 6 | 10 | 18 | 36.5 | 50 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中. | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II. | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,温度越高,铁的锈蚀速率越快. |
| ②氧气含量 | 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气. | 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II. | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快. |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇. | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I<II. | 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com