

分析 Ⅰ.根据观察到的现象和质量守恒定律进行分析;
Ⅱ.根据二氧化碳的性质分析解答;
Ⅲ.根据电解水的实现现象进行分析;
Ⅵ.根据探究可燃物燃烧的条件实验方法,现象,质量守恒定律分析解答.
解答 解:Ⅰ.图1所示实验中如果要验证生成的二氧化碳,可在烧杯内壁涂抹澄清石灰水,可观察到的现象是澄清石灰水变浑浊,说明二氧化碳与氢氧化钙发生反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
Ⅱ.向两根一高一低的燃烧的蜡烛通入二氧化碳,现象是下层的蜡烛火焰先熄灭,上层的蜡烛火焰后熄灭,此现象说明CO2本身不燃烧也不支持燃烧,密度比空气密度大.本身不燃烧也不支持燃烧,密度比空气密度大.
Ⅲ.电解水时,与直流电源正极相连的玻璃管中生成的气体是氧气,能使带火星的木条复燃,反应的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
Ⅵ.根据实验现象,放在水中不能与空气接触的白磷不能燃烧,而放在铜片上能与空气接触的白磷能燃烧,说明物质的燃烧需要空气(氧气);烧杯中的水温度为80℃,根据热的传递,铜片的温度可接近80℃,这时白磷能燃烧,说明白磷的着火点应该小于80℃.白磷燃烧的化学方程方程式为:4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$ 2P2O5;
故答案为:Ⅰ.澄清石灰水;澄清石灰水变浑浊;CO2+Ca(OH)2═CaCO3↓+H2O;Ⅱ.不燃烧也不支持燃烧;密度比空气密度大;Ⅲ.2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;带火星的木条靠近导管口,观察带火星的木条是否复燃;Ⅵ.探究可燃物燃烧的条件;4P+5O2 $\frac{\underline{\;点燃\;}}{\;}$ 2P2O5;白磷着火点<80℃.
点评 化学来源于生产、生活,也服务于生产、生活,要学好化学知识,为生产、生活服务.


科目:初中化学 来源: 题型:选择题
| A. | 溶液甲一定是不饱和溶液 | B. | 溶液乙一定是饱和溶液 | ||
| C. | 溶液丙、丁一定是饱和溶液 | D. | 溶液丙蒸发5g水,析出ag晶体,a=1 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一个二氧化碳分子是由一个碳原子和两个氧原子构成的 | |
| B. | 二氧化碳是由碳原子和氧原子组成的 | |
| C. | 常温下二氧化碳是一种无色无味无毒的气体 | |
| D. | 大气中二氧化碳的消耗途径主要是植物的光合作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 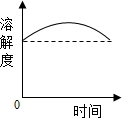 某温度向一定量的饱和Ca(OH)2溶液中加入少量CaO,再恢复到原温度 | |
| B. | 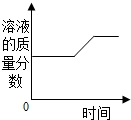 将烧杯中的饱和硝酸钾溶液恒温蒸发部分溶剂,再将烧杯中的物质逐渐升温 | |
| C. |  向等质量等浓度的稀硫酸中加入金属 | |
| D. | 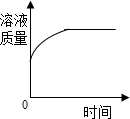 一定量硝酸银溶液中加入铁片 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
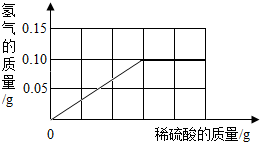 现有铁、铜组成的混合物10g,向其中逐滴加入质量分数为9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
现有铁、铜组成的混合物10g,向其中逐滴加入质量分数为9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 分析 |
| 取m克纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 如果CaCl2不过量,则会造成所计算的纯碱质量分数偏小(选填:偏大或偏小或不变) |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 下列物质均为初中化学中常见的物质,其中A、B的组成元素相同,A、B、D、E、F为氧化物,H为改良酸性土壤常用的物质,下图是它们之间的转化关系,请回答:
下列物质均为初中化学中常见的物质,其中A、B的组成元素相同,A、B、D、E、F为氧化物,H为改良酸性土壤常用的物质,下图是它们之间的转化关系,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com