
| A. | Fe 3+ SO42- H+ Cl- | B. | Mg2+ Cl- OH- Na+ | ||
| C. | H+ Ba2+ NO3- SO42- | D. | H+ Na+ K+ NO3- |
分析 根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存;本题还要注意溶液呈无色透明,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.
解答 解:A、四种离子间不能结合成沉淀、气体或水,能大量共存;但Fe3+的水溶液黄色,故选项错误.
B、Mg2+与OH-能结合成氢氧化镁沉淀,不能大量共存,故选项错误.
C、Ba2+与SO42-能结合成硫酸钡白色沉淀,不能大量共存,故选项错误.
D、四种离子间不能结合成沉淀、气体或水,能大量共存;且不存在有色离子,故选项正确.
故选:D.
点评 本题考查了离子共存的问题,判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水;溶液是无色时,不能有带色的离子.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
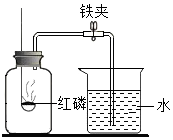 在“空气中氧气含量的测定”实验探究中,甲生设计了如下实验方案:
在“空气中氧气含量的测定”实验探究中,甲生设计了如下实验方案:| 组别 | 1 | 2 | 3 | 4 | 5 | 6 |
| 进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C、D是初中化学常见的四种物质,他们之间的转化关系如图所示,横线相连的物质能相互反应,箭头指向是生成物(部分反应物、生成物、反应条件已略去).已知D是一种最常见的溶剂.请回答下列问题:
A、B、C、D是初中化学常见的四种物质,他们之间的转化关系如图所示,横线相连的物质能相互反应,箭头指向是生成物(部分反应物、生成物、反应条件已略去).已知D是一种最常见的溶剂.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 均一、稳定的液体都是溶液 | B. | 溶液中一定含有水 | ||
| C. | 气体也能作溶质 | D. | 物质溶于水,溶液温度一定升高 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com