
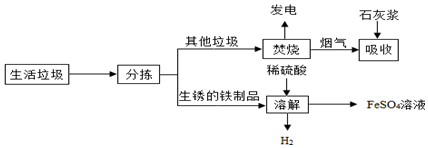
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
分析 (1)发电厂是利用垃圾焚烧产生的热能转变为电能;
(2)根据石灰浆是碱性分析;
(3)根据溶解过程中发生的化学反应来分析;
(4)根据氮气的化学性质来分析;
(5)根据图表中的信息可以知道当温度大于64℃时产生了FeSO4•4H2O,可以据此解答该题;
(6)根据题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁、二氧化硫和三氧化硫,可以据此写出该反应的化学方程式.
解答 解:(1)发电厂是利用垃圾焚烧产生的热能转变为电能;故填:热;
(2)石灰浆显碱性,能够吸收酸性气体,所以吸收步骤中,石灰浆的作用是除去烟气中含有的SO2、HCl;故填:Ca(OH)2+SO2=CaSO3+H2O(或Ca(OH)2+2HCl=CaCl2+H2O);
(3)溶解步骤中,硫酸与铁反应,生成氢气,所以产生的H2的化学方程式为Fe+H2SO4═FeSO4+H2↑; 故填:Fe+H2SO4═FeSO4+H2↑;
(4)氮气的化学性质稳定,其中氮气的作用是作保护气,避免+2价的铁元素被空气中的氧气氧化;故填:保护气,避免+2价的铁元素被空气中的氧气氧化;
(5)根据图表中的信息可以知道当温度大于64℃时产生了FeSO4•4H2O,所以应该将温度控制在64℃以下;故填:不超过64℃;
(6)通过题给的信息可以判断无水硫酸亚铁(FeSO4)隔绝空气加强热,生成产物有三氧化二铁和三氧化硫,在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等,所以结合元素化合价的变化可以知道,铁元素的化合价由+2变成了+3价,所以反应中有二氧化硫生成,硫元素的化合价由+6降低到+4,所以根据质量守恒定律可以判断在该反应中还生成了三氧化硫,所以该反应的化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.故填:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.
点评 在解此类题时,应掌握化学方程式的书写、盐的化学性质等知识,并学会分析信息、提取信息,并根据所学知识结合所给信息进行解答.此题涉及的知识点较多,有一定的难度,需要同学们能够掌握全面的知识.


科目:初中化学 来源: 题型:选择题
| A. | 水的电解实验说明水是由氢气和氧气组成的 | |
| B. | 保持水的化学性质的最小粒子是水分子 | |
| C. | 用活性炭可除去水中的色素和异味 | |
| D. | 水是一种常见的溶剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
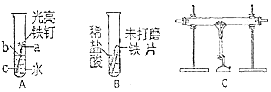 铁是生产、生活中应用很广泛的一种金属,下列实验装置与铁的性质有关,请回答下列问题
铁是生产、生活中应用很广泛的一种金属,下列实验装置与铁的性质有关,请回答下列问题查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物 质 | 所含杂质 | 除杂质的方法 |
| A | CaCl2溶液 | 稀盐酸 | 加入过量碳酸钙粉末,过滤 |
| B | 二氧化碳 | 氧气 | 通过灼热的铜网 |
| C | CuO固体 | Fe3O4 | 用磁铁吸引 |
| D | NaCl溶液 | CaCl2 | 加入过量碳酸钠溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 提出问题 | B. | 设计实验 | C. | 进行实验 | D. | 分析与论证 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验目的 | 实验步骤 | 实验现象 | 实验结论 |
| 实验一: 验证有无CaCO3 |  | 产生气泡 | 猜想一 不成立 |
| 实验二: 验证有无CaO | 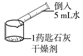 | 无明显放热现象 | 猜想三 成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A、B、C、D、E、F都是初中化学中涉及的物质,已知A、B、C、D都是氧化物,且A是黑色固体,F是蓝色固体,相互间的转化关系如图(反应条件部分反应物、生成物略去),“-”表示连线两端的物质能发生反应,“→”表示一种物质能转化为另一种物质.回答:
A、B、C、D、E、F都是初中化学中涉及的物质,已知A、B、C、D都是氧化物,且A是黑色固体,F是蓝色固体,相互间的转化关系如图(反应条件部分反应物、生成物略去),“-”表示连线两端的物质能发生反应,“→”表示一种物质能转化为另一种物质.回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com