
��ȤС���ͬѧѧϰ�˽��������ʺ���ʵ�����ҵ���һ������ɫ����R������̽����
��1��������RͶ��ϡ�����У���������������ð������ý���R�ڽ������˳������������ �� ��ѡ�ǰ�桱���桱����
��2��Ϊ�˱ȽϽ���R�����Ļ��ǿ������ȤС��������з�������ʵ�飬������±���
| ���һ�ֲ��� | ��֤���� | ���� | ���� |
| ����R�Ļ�Ա��� �� | ������RͶ�� �� ��Һ�� | ����R�����к�ɫ���������� | ���� �� ��ѡ���ȷ������ |
��3���������������Ϣ���������Fe��R��Cu�����н������˳����е���Ӧλ�á�
 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���һ�ֲ��� | ��֤���� | ���� | ���� |
| ����R�Ļ�Ա���ǿ | ������RͶ�� ��Һ�� |
����R�����к�ɫ���������� | ������ѡ���ȷ������ |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���һ�ֲ��� | ��֤���� | ���� | ���� |
| ����M�Ļ�Ա��� ǿ ǿ | ������MͶ�� FeSO4 FeSO4 ��Һ�� | ����M�����к�ɫ�������� | ���� ��ȷ ��ȷ �����ȷ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
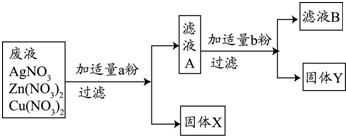
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ���ڣ�ʹ���γ�һ����Ϊ�����ĸ��ֽⷴӦ��֪ʶ���磮
���ڣ�ʹ���γ�һ����Ϊ�����ĸ��ֽⷴӦ��֪ʶ���磮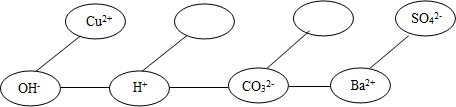
| ���� | ���ܼ�A�е��ܽ�� | ���ܼ�B�е��ܽ�� |
| AgNO3 | 170 | 86 |
| Ba��NO3��2 | 9.3 | 97.2 |
| AgCl | 1.5��10-4 | 0.8 |
| BaCl2 | 33.3 | ԼΪ0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com