小云同学在整理厨房时不小心将一瓶醋打翻,醋洒在火炉旁的一堆草木灰上,发现有大量的气泡生成,激发了兴趣,于是他决定与学习小组的同学对草木灰的成分进行探究.
[探究活动一]
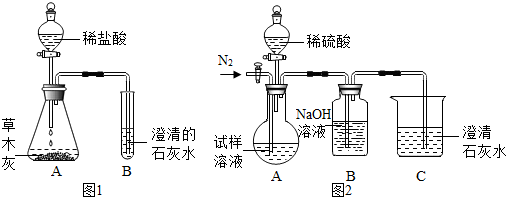
根据所学酸碱盐知识,同学们猜想草木灰中含有能与酸反应产生气体的盐类物质,于是,设计并进行如图1所示的实验.观察到锥形瓶A内有大量的气泡冒出,试管B中澄清的石灰水变浑浊.根据上述实验现象推断:草木灰中一定含有
碳酸盐
碳酸盐
(选填“硫酸盐”、“碳酸盐”或“硝酸盐”). 试管B中有关反应的化学方程式为
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.
[探究活动二]
资料摘要Ⅰ:多种金属化合物在灼烧时,产生的火焰呈现各种特殊的颜色,例如下表.
| 化合物所含金属元素 |
钙元素 |
钾元素 |
铜元素 |
| 灼烧产生火焰颜色 |
砖红色 |
紫色(透过蓝色钴玻璃片) |
绿色 |
资料摘要Ⅱ:碳酸钾与碳酸钠、碳酸氢钾与碳酸氢钠的化学性质相似;碳酸氢钠性质不稳定,受热易分解.
(1)同学们认为还必须对草木灰中存在的盐类物质中所含的金属元素进行探究.同学们在老师的指导下,取草木灰样品在火焰上灼烧,透过蓝色钴玻璃片观察到火焰呈
紫
紫
色,由此得出草木灰含有钾元素的结论.
(2)综合上述探究结果,进一步猜测草木灰中含有的钾盐是:
a.KHCO
3 b.
K2CO3
K2CO3
c.前两者的混合物.
(3)小红认为上述猜测
ac
ac
是错误的.理由是草木灰经柴草燃而成,
其中不可能存在受热易分解的KHCO3
其中不可能存在受热易分解的KHCO3
.
[探究活动三]
老师指出:草木灰成分复杂,其中所含其它成分的探究有待同学们后续进行.某同学设计了如图2中的装置进行实验,测定草木灰中碳酸钾的质量分数.(水蒸气的影响忽略不计,夹持装置已略去)
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;称量B瓶及溶液的质量为83.4g.
②称量30g样品,加适量蒸馏水溶解,过滤,得到试样溶液,放入锥形瓶中;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N
2; ⑤再次称量B瓶及溶液的质量为85.6g.
请回答下列问题:
(1)写出A中发生反应的化学方程式
K2CO3+2HCl═2KCl+H2O+CO2↑
K2CO3+2HCl═2KCl+H2O+CO2↑
,该样品中碳酸钾的质量分数为
23
23
%.
(2)鼓入一定量的N
2的目的是
将装置A中的二氧化碳排出被B吸收
将装置A中的二氧化碳排出被B吸收
,装置C中澄清石灰水的作用是
证明二氧化碳已被B完全吸收
证明二氧化碳已被B完全吸收
.

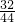 ×100%=6.4克,5.4g水中氧元素的质量为:5.4g×
×100%=6.4克,5.4g水中氧元素的质量为:5.4g×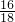 ×100%=4.8克,6.4g+4.8g=11.2g>9.6克,所以该化合物中一定还含有氧元素,故A正确;
×100%=4.8克,6.4g+4.8g=11.2g>9.6克,所以该化合物中一定还含有氧元素,故A正确;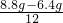 :
: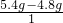 =1:3,故C正确;
=1:3,故C正确;

 阅读快车系列答案
阅读快车系列答案