
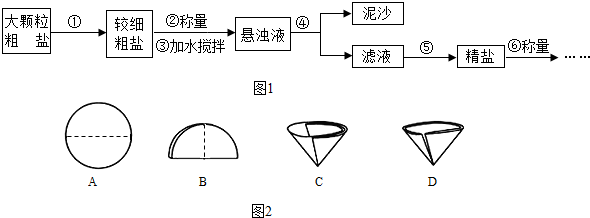
分析 (1)操作①是将大颗粒食盐变为小颗粒食盐,据此进行分析解答.
根据图示中的滤纸的折叠的方法,进行分析解答.
(2)操作③④⑤分别是溶解、过滤、蒸发操作,结合所需的仪器,蒸发操作的注意事项,进行分析解答.
(3)根据精盐产率=$\frac{精盐的质量}{粗盐的质量}$×100%,氯化钠未完全溶解、蒸发时滤液或食盐飞溅等,会导致蒸发得到的精盐质量偏小,据此进行分析判断.
解答 解:(1)操作①是将大颗粒食盐变为小颗粒食盐,通常使用的仪器是研钵.
A、B、C 是滤纸的正确的折叠方法,D中的滤纸,接口处出现缝隙,液体会直接的进入下面的烧杯,故不应该出现.
(2)操作③为:粗盐溶解;操作④含有泥沙的混合液经过过滤,得较纯净的氯化钠溶液;操作⑤蒸发滤液,得氯化钠晶体;三步操作都要用到得一种玻璃仪器是玻璃棒.进行蒸发操作时,待蒸发皿中出现较多的固体时,应停止加热.
(3)A.食盐没有全部溶解即过滤,会导致则会使得到的精盐的质量偏小,而使精盐的产率偏低.
B.蒸发过程中发生了液滴飞溅,会导致到的精盐的质量偏小,而使精盐的产率偏低.
C.蒸发皿上沾有的精盐没全部转移到称量纸上,会导致则会使得到的精盐的质量偏小,而使精盐的产率偏低.
故答案为:(1)研钵;D;(2)玻璃棒;出现较多的固体;(3)ABC.
点评 本题难度不大,熟练掌握粗盐的提纯的原理与实验步骤、影响制得的精盐的产率偏低的因素等是正确解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 大量使用农药、化肥 | |
| B. | 公交车由燃油、燃气改为电动新能源 | |
| C. | 燃放烟花爆竹,增加节日喜庆气氛 | |
| D. | 将生活垃圾及植物秸秆焚烧掉保持环境整洁 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用稀硫酸清洗用一氧化碳还原氧化铁后留下的固体物质 | |
| B. | 用稀盐酸清洗久盛石灰水留下的白膜 | |
| C. | 用热的纯碱溶液和水清洗附有植物油的试管 | |
| D. | 用稀硫酸清洗用氢气还原氧化铜后留下的固体物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 镓(Ga)是灰蓝色或银白色的金属,主要用于电子工业和通讯领域,是制取各种镓化合物半导体的原料.如图是元素周期表中提供的镓元素的部分信息及镓原子的结构示意图.下列有关说法错误的是( )
镓(Ga)是灰蓝色或银白色的金属,主要用于电子工业和通讯领域,是制取各种镓化合物半导体的原料.如图是元素周期表中提供的镓元素的部分信息及镓原子的结构示意图.下列有关说法错误的是( )| A. | 镓原子核外共有31个电子,最外层有3个电子 | |
| B. | 镓的相对原子质量为69.72,原子核内质子数为31 | |
| C. | 氧化镓的化学式为Ca2O3,其中镓元素的化合价为+3价 | |
| D. | 镓元素属于金属元素,镓原子在化学反应中易得电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子在不断运动 | B. | 分子之间有间隙 | ||
| C. | 分子的质量和体积都很小 | D. | 分子的大小随温度的升高而变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
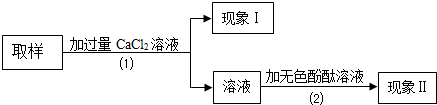
| 假设和现象 | 判断和化学方程式 | |
| a | 若现象Ⅰ无白色沉淀产生,现象Ⅱ溶液变红色 | 则该样品中溶质是氢氧化钠(填名称). |
| b | 若现象Ⅰ有白色沉淀产生,现象Ⅱ溶液变红色 | 则该样品中溶质是氢氧化钠和碳酸钠(填名称).该反应化学方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl.. |
| c | 若现象Ⅰ有白色沉淀产生,现象Ⅱ溶液不变色 | 则该样品中溶质是碳酸钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素是由碳、氢、氧三种元素组成 | |
| B. | 相对分子质量为282g | |
| C. | 碳元素的质量分数约为63.8% | |
| D. | 碳、氢、氧元素的原子个数比为15:22:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com