某兴趣小组用2.5克一氧化碳做还原氧化铜实验,将收集到的所有尾气通入50.8克的氢氧化钠溶液中,恰好完全反应得到53克碳酸钠溶液.试计算:
(1)Na2CO3的式量.
(2)所得碳酸钠溶液中溶质的质量分数.
(3)2.5克一氧化碳中参加反应的一氧化碳的质量分数.
解:(1)根据溶液质量的增加量就是参加反应的二氧化碳的质量:所以参加反应的二氧化碳的质量=53g-50.8g=2.2g,设有2.2g二氧化碳参加反应需要碳酸钠质量为X则:
CO
2+2NaOH═Na
2CO
3+H
2O
44 106
2.2g X
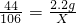
解得X=5.3g,
所以碳酸钠的质量为5.3g;
(2)因为碳酸钠质量为:5.3g,所以所得碳酸钠溶液中溶质的质量分数为:
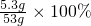
=10%;
(3)设要生成2.2g二氧化碳,需参加反应的一氧化碳质量为X则:
CO+CuO

Cu+CO
2
28 44
X 2.2g
根据:
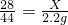
解得X=1.4g,
所以2.5克一氧化碳中参加反应的一氧化碳的质量分数为
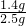
×100%=56%
故答案为:
(1)5.3g;
(2)10%;
(3)56%.
分析:(1)根据溶液质量的增加量就是参加反应的二氧化碳的质量:所以参加反应的二氧化碳的质量=53g-50.8g=2.2g,根据二氧化碳的质量算出碳酸钠的质量;(2)根据二氧化碳的质量算出碳酸钠的质量,再除以碳酸钠溶液的总质量,乘以百分之百;(3)根据一氧化碳还原氧化铜,生成二氧化碳和铜,根据二氧化碳的质量算出一氧化碳的质量,再用一氧化碳的质量除以2.5g,乘以百分之百即可.
点评:解答本题要知道一氧化碳与氧化铜反应生成铜和二氧化碳,二氧化碳与氢氧化钠反应生成碳酸钠和水,根据二氧化碳的质量算出碳酸钠的质量,再除以碳酸钠溶液的质量算出碳酸钠溶液的质量分数;根据二氧化碳的质量算出一氧化碳的质量,再除以2.5g,乘以百分之百.

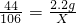
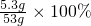 =10%;
=10%; Cu+CO2
Cu+CO2 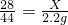
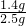 ×100%=56%
×100%=56%

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案