
【题目】写出下列反应的化学方程式
(1)硫在氧气中燃烧_____
(2)铁与硫酸铜溶液反应_____
(3)氢氧化钠溶液与稀硫酸混合_____.
【答案】S+O2![]() SO2 Fe+CuSO4═FeSO4+Cu 2NaOH+H2SO4═Na2SO4+2H2O
SO2 Fe+CuSO4═FeSO4+Cu 2NaOH+H2SO4═Na2SO4+2H2O
【解析】
首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
(1)硫在氧气中燃烧生成二氧化硫,反应的化学方程式为:S+O2![]() SO2.
SO2.
(2)铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
(3)氢氧化钠溶液与稀硫酸混合生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
故答案为:(1)S+O2![]() SO2;(2)Fe+CuSO4═FeSO4+Cu;(3)2NaOH+H2SO4═Na2SO4+2H2O.
SO2;(2)Fe+CuSO4═FeSO4+Cu;(3)2NaOH+H2SO4═Na2SO4+2H2O.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。则下列有关说法中不正确的是
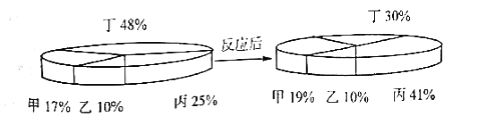
A. 生成的甲、丙两物质的质量比例为1:8 B. 乙一定是这个反应的催化剂
C. 甲可能是单质 D. 参加反应的丁的质量一定等于生成甲和丙的质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有一包含有杂质的BaCl2固体样品(杂质不溶于水),为了研究样品的组成,进行了如下试验。请回答下列问题:
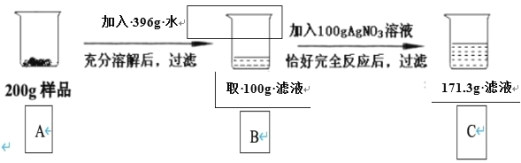
(1)实验发生反应的化学方程式为_____。
(2)列出求解硝酸银溶液中溶质质量(x)的比例式_____。
(3)200g固体样品加水充分溶解后,所得溶液的溶质质量分数为_____。
(4)在C烧杯加入多少克水使其中滤液的溶质质量分数为10%_____。
(5)向烧杯中加入硝酸银溶液的过程中,用数据说明滤液中溶质的变化情况是_____。
(6)样品中BaCl2的纯度为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】比较、归类是学习化学常用的方法。
(1)初中化学实验可以按照实验目的分为:“混合物分离提纯实验”、“探究物质反应条件实验”、“探究物质性质的实验”等。据此我们可以将实验C与实验①____________ (填字母)归为一类,分类依据是②__________。
A | B | C | D |
|
|
|
|
(2)在金属活动性顺序中,钙的活动性较强,不能与活动性位于它之后的盐溶液直接发生置换反应,而是先与水发生置换反应生成氢氧化钙和氢气。已知钡的活动性比钙还强,在元素周期表中钡和钙属于同一族,两种元素原子的①_____相同,化学性质相似。请写出金属钡与水反应生成的化合物的化学式②_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)已知某固体混合物中可能含有NH4Cl、Na2SO4、NH4NO3、CuO,所有发生的反应都恰好完全反应。根据实验过程和发生的现象填写以下空白:
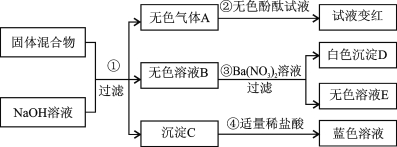
(1)气体A溶液的pH_______7。
(2)沉淀D的化学式为 。
(3)一定有的物质是 。
(4)该固体混合物中,还不能确定存在的是 ,(写化学式)要进一步推理该固体混合物的组成,可用溶液E再实验确定可能含有的物质:
实验操作 | 实验现象 | 实验结论 |
取未知成分溶液E少许,加入 溶液, | (用化学式表示) |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属及其制品是现代生活中常见的材料,请回答下列问题:
(1)铁和铝都可以制作炊具,主要利用了它们的_____(填“导电”或“导热”)性.
(2)在空气中_____(填“铝”或“铁”)制品更耐腐蚀.
(3)工业上制金属钛(Ti)是在高温下,用镁与TiCl4发生置换反应而得到钛,写出该反应的化学方程式_______.
(4)向氯化铜和氯化镁混合溶液中加入一定量的锌粉,待充分反应后过滤,向滤渣中滴加稀盐酸,有气体产生,则滤渣中一定含有_____(填化学式),滤液中一定含有的溶质为____(填化学式).
(5)小明用6.5g可能含有铜、铝、镁中的一种或几种杂质的锌粉样品,跟足量的稀盐酸完全反应,生成0.2g氢气,则此锌粉样品中一定含有的杂质是_____.
(6)用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是_____t(计算结果保留到0.1).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】试剂A、B、C是Na2CO3溶液、稀盐酸、Ca(OH) 2溶液中的一种。某同学进行如图所示的实验,观察到试管①中无明显现象,试管②中溶液变浑浊。实验结束后,该同学把试管①、②中的物质全部倒入烧杯中,发现溶液变澄清,并有气泡冒出。
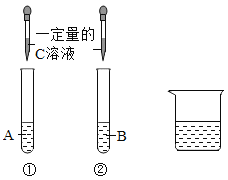
(1)A是_____________,B的溶质是_____________(填俗名)。
(2)写出试管A中的反应化学方程式:_____________。
(3)写出烧杯中溶液变澄清的反应化学方程式:_____________。
(4)烧杯中所得溶液的溶质可能是_____________(填序号)。
a NaCl、 Na2CO3
b NaCl、CaCl2、HCl
c NaCl、CaCl2
d NaCl、CaCl2、Na2CO3
查看答案和解析>>
科目:初中化学 来源: 题型:
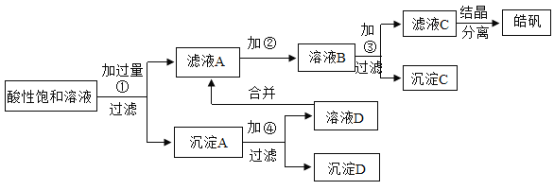
【题目】实验室制取皓矾![]() ,晶体析出前的酸性饱和溶液中含有少量的
,晶体析出前的酸性饱和溶液中含有少量的![]() 、
、![]() 和
和![]() 等杂质离子,为了除去杂质,获得纯净的皓矾晶体,设计如下工艺流程:
等杂质离子,为了除去杂质,获得纯净的皓矾晶体,设计如下工艺流程:
已知开始生成氢氧化物沉淀到沉淀完全的![]() 值范围分别为:
值范围分别为:![]() :2.7~3.7;
:2.7~3.7;![]() :7.6~9.6;
:7.6~9.6;![]() :5.7~8.0;
:5.7~8.0;
试回答下列有关的问题:
(1)加入的试剂①应是_____。
(2)加入的试剂②是供选择使用的氧化剂:高锰酸钾溶液、20%的过氧化氢![]() 、浓硝酸。应选用_____最好,其理由是_____。
、浓硝酸。应选用_____最好,其理由是_____。
(3)加入试剂③是_____,其目的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年5月18日我国第一艘国产航母试海成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜、锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量/g | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为________g
(2)该黄铜中铜的质量分数为多少_______?(写出计算过程)
(3)第三次实验后所得溶液的溶质为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com