
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:初中化学 来源: 题型:选择题
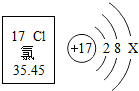
| A. | 氯原子的质子数是 17 | B. | 氯原子核外有 3个电子层 | ||
| C. | 当 X=8时,该微粒是阴离子 | D. | 在化学变化中,氯原子易失电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
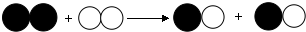
| A. | 该反应生成两种物质 | B. | 化学反应前后原子的种类不变 | ||
| C. | 该反应是复分解反应 | D. | 分子在化学变化中是不可分的 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).已知A、H为固体,通常均可在食品包装袋中用于保存食品.人体胃酸中有大量M存在.A、B、C含有两种相同的元素.请回答下列问题:
同学们依据物质类别和物质中某种元素的化合价构建了初中化学常见物质间的转化关系坐标图(图中“→”表示物质间的转化).已知A、H为固体,通常均可在食品包装袋中用于保存食品.人体胃酸中有大量M存在.A、B、C含有两种相同的元素.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是有关氧气的知识网络图(反应条件部分省略),用化学用语回答问题.
如图是有关氧气的知识网络图(反应条件部分省略),用化学用语回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
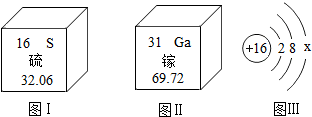 Ga2S3(硫化镓)是制作二维超薄半导体的材料之一.图Ⅰ、图Ⅱ分别是硫元素和镓元素在周期表中的信息,图Ⅲ是硫原子的原子结构示意图.图Ⅲ中X的数值为6,镓元素的相对原子质量是69.72,硫化镓属于化合物(选填“单质”、“化合物”、或“混合物”).
Ga2S3(硫化镓)是制作二维超薄半导体的材料之一.图Ⅰ、图Ⅱ分别是硫元素和镓元素在周期表中的信息,图Ⅲ是硫原子的原子结构示意图.图Ⅲ中X的数值为6,镓元素的相对原子质量是69.72,硫化镓属于化合物(选填“单质”、“化合物”、或“混合物”).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
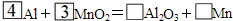
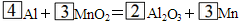
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com