
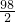 =
=
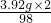 =0.08g
=0.08g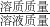 ×100%,则溶液质量=
×100%,则溶液质量=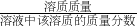 ,溶质质量=溶液质量×溶液中溶质的质量分数;根据化学方程式计算代入的数据必须是纯物质的质量.
,溶质质量=溶液质量×溶液中溶质的质量分数;根据化学方程式计算代入的数据必须是纯物质的质量.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实
验室现有的是溶质质量分数为98%的浓硫酸。试计算:
(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?
(2)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?(反应的化学方程式为Zn +H2SO4===ZnSO4 + H2↑)
查看答案和解析>>
科目:初中化学 来源:2013年河北省中考化学模拟试卷(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2010年贵州省毕节地区中考化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com