
| 实验编号 | 实验① | 实验② | 实验③ | 实验④ |
| 实验图示 |  | 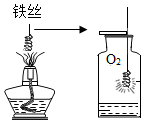 | 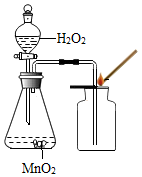 | 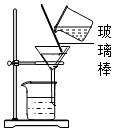 |
| 实验编号 | 实验⑤ | 实验⑥ | 实验⑦ | 实验⑧ |
| 实验图示 | 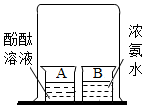 | 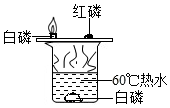 |  |  |
分析 (1)根据测定空气中氧气含量的实验的原理分析.物质在瓶内燃烧后,物质燃烧消耗了氧气,瓶内压强降低,同时没有生成新的气体分析;
(2)根据细铁丝在氧气里燃烧的实验注意事项进行分析解答即可.
(3)根据装置的特点分析,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.
(4)玻璃棒的一般作用有搅拌、引流、转移固体等.
(5)因为浓氨水有挥发性,溶于水呈碱性,能使无色的酚酞试液变红色,通过对比实验,此实验说明了分子在不断运动.
(6)根据灭火的原理来分析.
(7)根据二氧化碳密度比空气大且不支持燃烧的性质可以分析出哪一支蜡烛先熄灭;
(8)CO2能与氢氧化钠溶液反应生成碳酸钠和水.
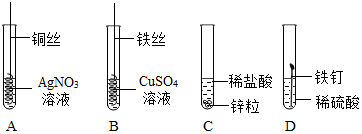
解答 解:(1)木炭燃烧能生成二氧化碳气体,不会形成气压差.磷能在空气中燃烧,且生成物是固体,可以形成气压差;铁丝在空气中不能燃烧.故选:磷;(2)铁丝在氧气中剧烈燃烧,火星四射,放出大量的热,为防止生成物熔化溅落下来炸裂集气瓶,要在集气瓶中预先加入少量的水.
故答案为:防止生成物熔化溅落下来炸裂集气瓶.
(3)实验③中适用于固体与液体常温下制取氧气,可用过氧化氢在二氧化锰的催化作用下制取氧气,反应的方程式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.氧气的密度比空气的密度大,因此能用向上排空气法.实氧气的验满方法是:将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了.故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;大;将带火星的木条平放在集气瓶口,木条复燃,证明氧气满了;
(4)在过滤操作中的作用是引流;故答案为:引流;
(5)因为浓氨水有挥发性,溶于水呈碱性,能使无色的酚酞试液变红色,通过对比实验,此实验说明了分子在不断运动.故填:分子在不断运动;
(6)热水中的白磷没有和氧气接触,所以不能燃烧,故可得燃烧的条件之一:与氧气接触;利用这一知识灭火实例有:用灯帽盖灭酒精灯或用锅盖盖灭着火的油锅等;故填:灯帽盖灭酒精灯或用锅盖盖灭着火的油锅等;
(7)因为二氧化碳密度比空气大且不支持燃烧,所以下面的蜡烛先熄灭,然后上面的蜡烛才熄灭.故填:下面的蜡烛先熄灭,然后上面的蜡烛才熄灭;
(8)CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则;二氧化碳和氢氧化钠反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.故填:CO2+2NaOH=Na2CO3+H2O.
点评 此题考察知识点的方式比较灵活,但并不是难题,同学们只要掌握相关知识就可以顺利完成该题.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 丁酸乙酯是有机高分子化合物 | |
| B. | 丁酸乙酯中碳元素的质量分数最大 | |
| C. | 一个丁酸乙酯分子只能怪含有62个质子 | |
| D. | 丁酸乙酯中碳、氢、氧三种元素的质量比是3:6:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子的质量大,原子的质量小 | |
| B. | 在化学变化中,原子的种类和个数不变 | |
| C. | 原子是化学变化中的最小粒子 | |
| D. | 分子、原子、离子是构成物质的微观粒子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com