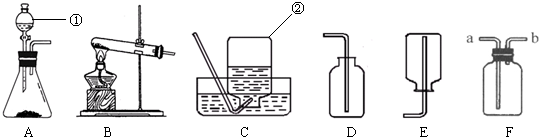
解:(1)A装置是固液常温型装置制取氧气,因此只能用双氧水溶液在二氧化锰催化剂作用下分解制氧气,反应的化学方程式2H
2O
2
2H
2O+O
2↑;氧气不易溶于水,可以用排水法收集氧气,仪器②的名称是集气瓶.
(2)无水醋酸钠和碱石灰为固体,反应条件为加热,因此要选择给固体加热装置制甲烷气体.故发生装置选B;甲烷的密度比空气小,难溶于水.如果采用装置F收集甲烷,甲烷应从b端进入,将空气沿a端排出.
(3)用高锰酸钾(KMnO
4)制取氧气时在试管口应放一小团棉花,防止高锰酸钾加热时飞溅进入导管,使水槽中的水变成了浅紫红色,高锰酸钾的相对分子质量为 39+55+16×4=158,实验测知:在反应过程中,高锰酸钾分子中有四分之一的氧原子重新组合为氧分子,所以316g高锰酸钾完全反应后可得到氧气为316g×
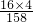
×

=32g.
故答案为:(1)2H
2O
2
2H
2O+O
2↑;氧气不易溶于水;集气瓶.
(2)B; b.
(3)试管口未放一小团棉花;158; 32.
分析:(1)根据制取氧气的装置选择原理,根据氧气的密度和溶解性选择收集方法.
(2)根据反应物状态和反应条件选择发生装置,根据气体的密度和溶解性选择收集装置;
(3)根据高锰酸钾制氧气的注意事项解答,根据元素质量守恒求解氧气的质量.
点评:熟练掌握实验室制氧气的原理、装置、会根据元素质量守恒法进行计算.

 2H2O+O2↑;氧气不易溶于水,可以用排水法收集氧气,仪器②的名称是集气瓶.
2H2O+O2↑;氧气不易溶于水,可以用排水法收集氧气,仪器②的名称是集气瓶.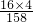 ×
× =32g.
=32g. 2H2O+O2↑;氧气不易溶于水;集气瓶.
2H2O+O2↑;氧气不易溶于水;集气瓶.

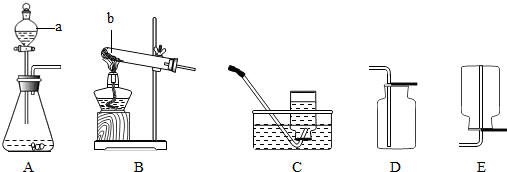
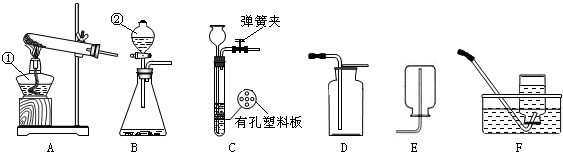
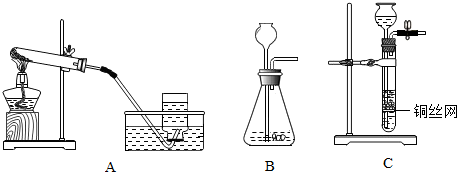
 通过化学学习,你已经掌握了实验室制取气体的一些规律,请结合下图回答问题:
通过化学学习,你已经掌握了实验室制取气体的一些规律,请结合下图回答问题: