
 优学名师名题系列答案
优学名师名题系列答案科目:初中化学 来源: 题型:阅读理解

| 编号 | 实验I | 实验II | 实验III |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 16、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
16、小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.| 实验步骤 | 可能出现的现象 | 结论 |
溶液变成红色 |
CaO2与H2O反应有Ca(OH)2生成 | |
溶液不变色 |
CaO2与H2O反应无Ca(OH)2生成 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2013?南通一模)珍珠粉常为消费者喜爱,然而一些不法分子用贝壳粉冒充珍珠粉销售.一研究性学习小组为了鉴定某珍珠粉的真假,进行了以下探究.
(2013?南通一模)珍珠粉常为消费者喜爱,然而一些不法分子用贝壳粉冒充珍珠粉销售.一研究性学习小组为了鉴定某珍珠粉的真假,进行了以下探究.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
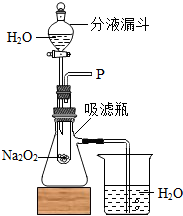 (2010?常德)在校园文艺节上,萌萌同学表演的“水能生火“的化学小魔术博得了满堂彩,她向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.事后她对这魔术的化学原理很感兴趣,于是便和同学们一起探究起来.
(2010?常德)在校园文艺节上,萌萌同学表演的“水能生火“的化学小魔术博得了满堂彩,她向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.事后她对这魔术的化学原理很感兴趣,于是便和同学们一起探究起来.| 实验步骤 | 实验现象 | 实验结论 |
| 取少量探究1反应后的溶 液于试管中,加入稀盐酸. |
无现象 无现象 |
生成物中 生成物中 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究下列各题:
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究下列各题:| 实验步骤 | 可能出现的现象 | 结论 |
| CaO2与H2O反应有Ca(OH)2生成 | ||
| CaO2与H2O反应无Ca(OH)2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com