
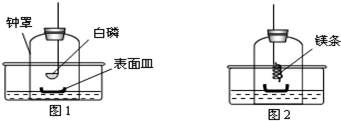
分析 (1)根据实验目的探究镁条能否与氮气反应分析白磷燃烧的目的;
(2)根据镁与氮气的反应写出反应的化学方程式;
(3)根据氮化镁(Mg3N2)能和水反应,生成Mg(OH)2和NH3,写出反应的化学方程式;
(4)根据极端假设全部生成氧化镁或氮化镁,分别求出其质量.
解答 解:(1)要验证镁条在氮气中能否燃烧,需将空气中的氧气除去,因此步骤①中足量白磷在钟罩内燃烧的目的是 除去钟罩内空气中的氧气,防止空气中氧气对实验的干扰,以便镁条在氮气中燃烧;
(2)由题意可知,镁条在氮气中剧烈燃烧生成氮化镁,反应的化学方程式为:3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;
(3)步骤④中钟罩内壁及表面皿中出现淡黄色固体.此固体为氮化镁(Mg3N2),能和水反应,生成Mg(OH)2和NH3,因此加入水中,产生白色沉淀氢氧化镁及能使湿润红色石蕊试纸变 蓝色的气体氨气,反应的化学方程式为 Mg3N2+6H2O═3Mg(OH)2+2NH3↑;
(5)设2.4g镁全部与氧气反应,则生成氧化镁的质量为:$\frac{2.4g}{\frac{24}{24}}$═4g 设2.4g镁全部与氮气反应生成氮化镁,则生成的氮化镁的质量为:$\frac{2.4g}{\frac{24×3}{24×3+14×2}}$=3.33g;因此2.40g镁条在某充满空气的密闭容器中完全燃烧,燃烧生成的固体质量应大于3.33g小于4g,所以,BD正确.
故答为:(1)消耗完钟罩内的氧气,防止空气中氧气对实验的干扰.(2)3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2;(3)Mg3N2+6H2O=3Mg(OH)2+2NH3↑;(4)B D.
点评 本题主要考查学生获取信息并运用信息的能力,解答本题的关键是要充分理解镁的性质,只有这样才能对问题做出正确的判断.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 把溶剂蒸发掉一半 | B. | 加入8g 食盐固体 | ||
| C. | 把溶剂蒸发掉20g | D. | 加入2g 食盐固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com