
| 实验步骤 | 实验现象 | 结论 |
| 先用pH试纸测定稀盐酸的 pH.再逐渐滴加氢氧化钠溶 液.并不断振荡,同时测定 混合液的pH | pH逐渐变大,最后PH≥7 | 稀盐酸与氢氧化钠溶液能发 生反应 |
| 实验步骤 | 实验现象 | 结论 |
| 稀盐酸与氢氧化钠溶液反应 放热. |
| 实验步骤 | 实验现象 | 结论 |
| 取少受上述反应后的溶液子 试管中.滴加硫酸铜溶液. | 若生成蓝色沉淀 | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀盐酸与氢氧化钠溶液恰好 完全反应 |
分析 酸溶液PH增大的原因可从物理或化学变化的角度分析,酸溶液被稀释其pH增大,酸中的氢离子被消耗其pH增大,氢氧化钠与盐酸反应生成氯化钠和水.
设计实验探究稀盐酸与氢氧化钠溶液的反应是否放热可以通过测定反应前后溶液的温度来进行确定,反应后的溶液中若氢氧化钠剩余,则加入硫酸铜会产生氢氧化铜蓝色沉淀,若无明显现象,则说明无氢氧化钠,剩余溶液可能为中性也可能为酸性.
解答 解:(1)酸溶液被稀释其pH会增大,所以强调只有测得的pH≥7才能证明反应发生是想说明已经无盐酸了,所以本题答案为:排除因氢氧化钠溶液的加入,稀释盐酸而引起pH变大(或只有pH≥7才能说明盐酸已经反应掉了);
(2)设计实验探究稀盐酸与氢氧化钠溶液的反应是否放热可以通过测定反应前后溶液的温度来进行确定,所以本题答案为:
| 实验步骤 | 实验现象 |
| 取一定量10%的氢氧化钠溶液于烧杯,插入温度计测温度,加入适量10%的盐酸,用玻璃棒搅拌,再测温度. | 温度计示数上升 |
| 实验步骤 | 实验现象 |
| 取一定量10%的氢氧化钠溶液于烧杯,插入温度计测温度,加入适量10%的盐酸,用玻璃棒搅拌,再测温度. | 温度计示数上升 |
| 实验步骤 | 实验现象 | 结论 |
| 取少受上述反应后的溶液子 试管中.滴加硫酸铜溶液. | 若 生成蓝色沉淀 | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀盐酸与氢氧化钠溶液恰好 完全反应 |
点评 本题考查了氢氧化钠和盐酸的中和反应,设计实验证明反应是否恰好完全进行以及反应过程中的能量问题,完成此题,可以依据课本已有的知识.所以要求同学们在平时的学习中要加强基础知识的储备,以便能够灵活应用.


科目:初中化学 来源: 题型:实验探究题
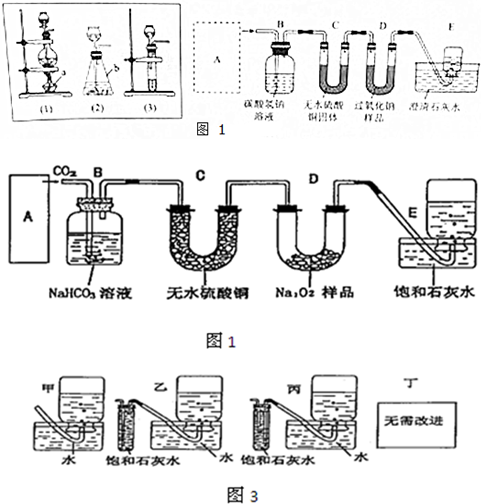
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
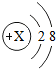 如图是某粒子的结构示意图,回答下列问题:
如图是某粒子的结构示意图,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
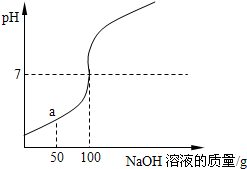 为测定某稀盐酸溶液溶质额质量分数,取100g该溶液溶于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如图所示.
为测定某稀盐酸溶液溶质额质量分数,取100g该溶液溶于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
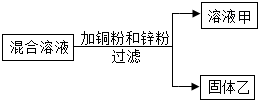 某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:( )
某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:( )| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com