

分析 (1)根据图中元素周期表可以获得的信息:原子序数、元素种类等,原子序数=质子数,当质子数=核外电子数,为原子;进行分析判断即可;
(2)活性炭有吸附性,煮沸能降低水的硬度;根据青少年在生长发育期,需要大量钙元素分析;
(3)①根据20℃时氯化钠的溶解度分析解答;
②打开汽水瓶冒出大量气泡,说明气体的溶解度与压强有关;
③根据硝酸钾和氢氧化钙的溶解度随温度变化情况及硝酸铵溶于水使溶液温度降低分析解答;
(4)首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可;
(5)根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析;
解答 解:(1)根据元素周期表中的一格中获取的信息,该元素的名称是硒,属于非金属元素,该元素的原子序数为34,x=34-2-8-18=6,由硒的原子结构示意图可知,原子最外层电子数为6,在化学反应中,硒原子容易得到2个电子形成稳定结构,硒离子为:Se2-.
(2)①由于活性炭有吸附性,能吸附色素和异味,常用净化水,生活中可以通过煮沸的方法降低水的硬度;
②青少年在生长发育期,需要大量钙元素,应多吃奶制品、虾皮等食物.
(3)①20℃时氯化钠的溶解度 是36g,即20℃时100g水中最多溶解36g氯化钠,故将20g NaCl加入50g水中最多溶解18g,形成溶液的质量为68g;
②打开汽水瓶冒出大量气泡,说明气体的溶解度随压强的减小而减小;
③硝酸铵溶于水使溶液温度降低,硝酸钾的溶解度随温度的降低而减小,氢氧化钙的溶解度随温度的降低而增大;故加入一定量的硝酸铵,溶解后甲试管内有硝酸钾晶体析出,乙试管变为不饱和溶液;
(4)工业上用一氧化碳还原赤铁矿石(主要成分为氧化铁)炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(5)向足量的澄清石灰水中通入二氧化碳,会观察到石灰水变浑浊,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,其化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.后变澄清,是因为碳酸钙与二氧化碳和水反应生成了可溶于水的碳酸氢钙的缘故,其化学方程式为:CaCO3+H2O+CO2=Ca(HCO3)2
故答案为:(1)非金属、6、得到、Se2-;
(2)①活性炭;煮沸; ②钙.
(3)①68g; ②压强; ③有晶体析出;不饱和;
(4)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(5)CO2+Ca(OH)2═CaCO3↓+H2O.CaCO3+H2O+CO2=Ca(HCO3)2.
点评 本题考查了常见物质的用途,完成此题,可以依据物质的性质进行,使用要求同学们在平时的学习中加强基础知识的储备,以便能够灵活应用.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ |
| 物质名称 | 甲烷 | 氧气 | 烧碱 | 干冰 |
| 化学式 | CH4 | O2 | NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
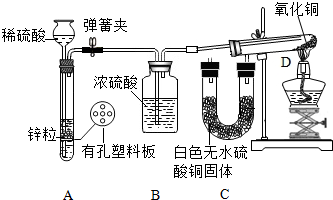
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
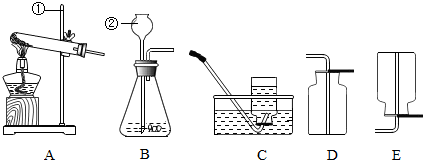
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
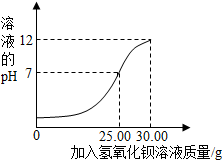
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
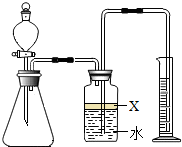 氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质,已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.现用如图所示中的一些装置来进行相关实验.根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).
氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质,已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.现用如图所示中的一些装置来进行相关实验.根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com