
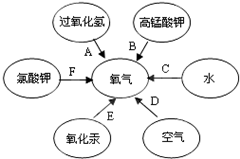
 有六种途径可以制得氧气,如图所示:
有六种途径可以制得氧气,如图所示:分析 (1)首先根据反应原理找出反应物、生成物、反应条件,根据方程式的书写方法、步骤进行书写即可;
(2)无新物质生成的变化是物理变化;
(3)根据二氧化锰的作用进行分析解答;
(4)根据“绿色化学”理念,最佳方法可从是否加热、生成物是否有污染等方面,进行分析解答.
解答 解:(1)A:过氧化氢在二氧化锰的催化作用下生成水和氧气,F:氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,故反应的方程式分别为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)分离液态空气制取氧气是根据液态氧和液态氮的沸点不同而分离的,没有产生新物质,是物理变化;故填:D;
(3)过氧化氢常温下就能分解产生氧气,氯酸钾单独加热也能产生氧气,但反应速度太慢,故加入二氧化锰作催化剂,能加快化学反应速度;故填:催化作用;
(4)过氧化氢分解制取氧气,不需加热,装置简单、操作简便、安全,生成物是水和氧气,无污染,根据“绿色化学”理念,是实验室制氧气的最佳方法;故填:A.
点评 本题难度不大,掌握实验室制取氧气的反应原理、方程式的书写方法、物理变化的特征等是正确解答本题的关键.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
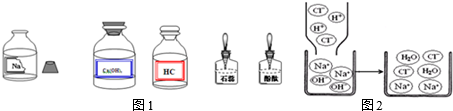
| A. | 用KMnO4粉末制取O2 | |
| B. | 用KClO3和MnO2制取O2 | |
| C. | 用Zn(固体)和稀硫酸制(液体)取H2 (密度比空气小,难溶于水) | |
| D. | 用石灰石(固体)和稀盐酸(液体)制取CO2(密度比空气大,溶于水) |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
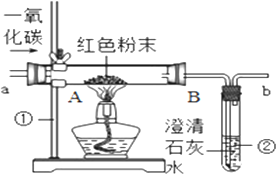 如图是课堂中模拟炼铁的实验装置.
如图是课堂中模拟炼铁的实验装置.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
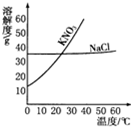 根据如图中KNO3和NaCl的溶解度曲线,回答下列问题.
根据如图中KNO3和NaCl的溶解度曲线,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
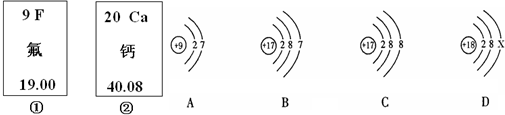
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2=CaCO3+2NaCl |
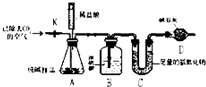
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com