
| A. | 只有① | B. | 只有② | C. | ③和④ | D. | ①和④ |
分析 燃烧后的产物依次通过浓硫酸和氢氧化钠溶液,经完全吸收后,测得浓硫酸和氢氧化钠溶液增重的质量比为9:11,说明气体充分燃烧后生成水和二氧化碳且二者质量比为9:11;根据水与二氧化碳的质量比确定气体中C、H元素质量比及原子个数比,判断气体的可能组成.
解答 解:根据题意,气体一定含C、H元素且两元素的质量比=(11×$\frac{12}{44}$×100%):(9×$\frac{2}{18}$×100%)=3:1,则气体中C、H原子个数比=$\frac{3}{12}$:$\frac{1}{1}$=1:4;因此该气体可能为CH4气体或CO与2H2的混合气体;
故选:AD.
点评 可燃物完全燃烧时,其中C元素全部生成二氧化碳、H元素全部生成水,生成二氧化碳与水中C、H元素质量即可燃物中所含C、H元素质量.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 乙醇(C2H6O) | B. | 丙酸(C3H6O2) | C. | 乙醛(C2H4O) | D. | 甲醇(CH4O) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠溶解度为36g | |
| B. | 溶解度与溶质、溶剂性质有很大关系 | |
| C. | 固体溶解度都随温度升高而增大 | |
| D. | 气体溶解度一般随压强增大而减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
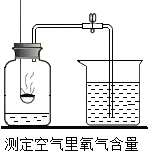 法国化学家拉瓦锡通过实验得出的结论是氧气约占空气总体积的$\frac{1}{5}$.某同学用如图装置进行验证,实验是利用可燃物红磷燃烧消耗瓶内的氧气,使瓶内压强减小来推测空气里氧气的含量.结果实验后发现气体减少的体积小于$\frac{1}{5}$.
法国化学家拉瓦锡通过实验得出的结论是氧气约占空气总体积的$\frac{1}{5}$.某同学用如图装置进行验证,实验是利用可燃物红磷燃烧消耗瓶内的氧气,使瓶内压强减小来推测空气里氧气的含量.结果实验后发现气体减少的体积小于$\frac{1}{5}$.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com