
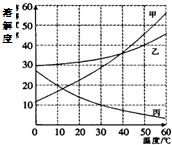
 甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线如图所示.
甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线如图所示.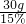 =200g;配制溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.
=200g;配制溶液的基本步骤:计算、称量、量取、溶解、装瓶存放.

 天天练口算系列答案
天天练口算系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:新人教版九年级上册《第6章 碳和碳的化合物》2013年单元检测训练卷B(二)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com