
根据下表信息回答:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
1 H 1.008 |
ⅡA |
ⅢA |
ⅣA |
V A |
ⅥA |
ⅦA |
2 He 4.003 |
|
2 |
3 Li 6.941 |
4 Be 9.012 |
5 B 10.8l |
6 C 12.01 |
7 N 14.0l |
8 O 16.00 |
9 F 19.00 |
10 Ne 20.18 |
|
3 |
|
|
|
Z |
|
|
|
|
(1)第10号元素的名称是 ,氧元素的原子失去电子形成的阴离子符号是 ,其离子结构示意图是 。
(2)第2周期共有 种固体非金属元素,该周期元素原子的核外 数相同。
(3)9号元素和17号元素的化学性质相似的原因是它们的 数相同; Z元素和8号元素形成化合物的化学式为 。
(1)氖
,O2- 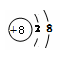 (2)2,电子层, (3) 最外层电子, SiO2
(2)2,电子层, (3) 最外层电子, SiO2
【解析】
试题分析:(1)根据元素周期表的一个小格的内容分析,第10号元素是Ne,故化学名称是氖;原子核外最外层电子数少于4个,一般容易失去电子形成阳离子;原子核外最外层电子数多于4个的,一般容易得到电子形成阴离子,由于氧元素的原子的最外层电子数为6,多于4个,故容易得到2个电子而达到8个电子的相对稳定结构,形成带2个单位负电荷的阴离子,其符号为O2-,其离子结构示意图是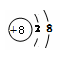 。
。
(2)根据原子最外层电子数的特点分析,非金属元素的原子最外层电子的数目一般多于4个,金属元素的原子最外层电子的数目一般少于4个,故第2周期中属于非金属元素的有 B、C、N、O、F,其中B、C属于固体非金属元素;该周期的元素原子的核外电子层数和周期数相同。
(3)元素的化学性质与原子核外的最外层电子数有密切关系,原子核外的最外层电子数相同,化学性质相似,由于9号元素和17号元素的原子核外的最外层电子数都是7,故它们的化学性质相似。由于Z元素是第14号元素,故为Si,8号元素为O,故它们形成化合物的化学式为SiO2。
考点:元素周期表的特点及其应用,核外电子在化学反应中的作用,原子结构示意图与离子结构示意图
点评:理解和熟练掌握元素周期表的特点及其应用,是解答本题的关键,并能根据原子结构示意图判断元素的化合价,会根据化合价书写化学式。


科目:初中化学 来源: 题型:
| 序号 | 金属 | 熔点/℃ | 导电性 | 硬度 | 化学性质 | 金属冶炼的大致年限 |
| ① | Al | 660 | 61 | 2~2.9 | 常温下与氧气反应,表面形成致密的薄膜 | 约200年前 |
| ② | Fe | 1535 | 17 | 4~5 | 在潮湿的空气着火易生锈 | 约3000年前 |
| ③ | Cu | 1083 | 99 | 2.5~3 | 在高温时易与氧气反应 | 约6000年前 |
| ④ | Al | 660 | 61 | 2~2.9 | 常温下与氧气反应,表面形成致密的薄膜 | 约200年前 |

查看答案和解析>>
科目:初中化学 来源: 题型:
| 序号 | 金属 | 熔点/℃ | 导电性 | 硬度 | 化学性质 | 金属冶炼的大致年限 |
| ① | Al | 660 | 61 | 2~2.9 | 常温下与氧气反应,表面形成致密的薄膜 | 约200年前 |
| ② | Fe | 1535 | 17 | 4~5 | 在潮湿的空气着火易生锈 | 约3000年前 |
| ③ | Cu | 1083 | 99 | 2.5~3 | 在高温时易与氧气反应 | 约6000年前 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | 1H 1.008 |
ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He 4.003 |
| 2 | 3Li 6.941 |
4Be 9.012 |
5B 10.81 |
6C 12.01 |
7N 14.01 |
8O 16.00 |
9F 19.00 |
10Ne 20.18 |
| 3 |  |
 |
 |
Z |  |
 |
 |
 |


查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属 | 熔点/℃ | 导电性 | 硬度 | 化学性质 | 冶炼的大致年限 |
| Al | 660 | 61 | 2~2.9 | 常温下与氧气反应,表面形成致密的薄膜 | 约200年前 |
| Fe | 1535 | 17 | 4~5 | 在潮湿的空气中易生锈 | 约3000年前 |
| Cu | 1083 | 99 | 2.5~3 | 在高温时与氧气反应 | 约6000年前 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com