
分析 赤铁矿与盐酸混合,铁矿中氧化铁和盐酸反应,得到氯化铁溶液,铁矿中杂质既不溶酸,也不溶于水,形成滤渣.所以,铁矿中氧化铁的质量为20g-4g=16g,利用氧化铁的质量求出生成的氯化铁的质量进而求出所得滤液中溶质的质量分数即可.
解答 解:(1)赤铁矿样品中Fe2O3的质量=20g-4g=16g;故赤铁矿样品中Fe2O3的质量分数(纯度)=$\frac{16g}{20g}$×100%=80%.
(2)设反应后生成氯化铁的质量为x.
Fe2O3+6HCl=2FeCl3+3H2O
160 325
16g x
$\frac{160}{325}=\frac{16g}{x}$,解之得 x=32.5g
反应后所得溶液质量=20g+84g-4g=100g,故反应后所得溶液中溶质的质量分数=$\frac{32.5g}{100g}$×100%=32.5%.
故答案为:(1)80%;(2)32.5%.
点评 本题主要考虑反应后溶液质量可根据质量守恒进行计算:反应后溶液质量=赤铁矿质量+稀盐酸质量-滤渣质量.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
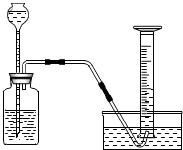 在学习了“金属的化学性质”后,小吴同学进行了如下探究:
在学习了“金属的化学性质”后,小吴同学进行了如下探究:| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com