
分析 (1)氢氧化钠和稀硫酸反应生成硫酸钠和水;
氢氧化钠溶液显碱性,能使酚酞试液变红色,能使石蕊试液变蓝色;
镁和稀硫酸反应生成硫酸镁和氢气;
显碱性溶液pH大于7,显中性溶液pH等于7,显酸性溶液pH小于7;
稀硫酸和氢氧化钠反应生成硫酸钠和水,同时放出大量的热;
(2)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水;
碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠.
解答 解:(1)氢氧化钠和稀硫酸反应生成硫酸钠和水,该反应的化学方程式是:2NaOH+H2SO4═Na2SO4+2H2O.
故填:2NaOH+H2SO4═Na2SO4+2H2O.
小清的猜想不正确,因为溶液由红色变成无色,所以溶液中不含有氢氧化钠.
故填:小清的猜想,因为溶液由红色变成无色,所以溶液中不含有氢氧化钠.
他们选择的试剂可能是石蕊试液或镁带,因为稀硫酸能使石蕊试液变红色,能和镁反应生成硫酸镁和氢气.
故填:AD.
A、用pH试纸测定氢氧化钠溶液的pH,然后向其中滴加稀硫酸,pH逐渐减少,最终小于7,说明氢氧化钠和稀硫酸发生了化学反应;
B、用温度计测试氢氧化钠溶液滴加稀硫酸前后的温度,温度明显上升,说明氢氧化钠和稀硫酸发生了化学反应,放出热量;
C、向一定量的氢氧化钠溶液滴加稀硫酸后再滴加硫酸铜溶液,有蓝色沉淀生成,说明溶液中含有氢氧化钠,不能说明氢氧化钠和稀硫酸发生了反应;
D、向一定量的氢氧化钠溶液中滴加稀硫酸后再滴加碳酸钠溶液,有无色气泡产生,说明溶液中含有稀硫酸,不能说明氢氧化钠和稀硫酸发生了反应.
故填:AB.
(2)氢氧化钠在空气中发生变质的反应方程式为:2NaOH+CO2═Na2CO3+H2O.
故填:2NaOH+CO2═Na2CO3+H2O.
①取少量氢氧化钠溶液装入试管中,加入足量的氯化钙溶液,观察到溶液中产生白色沉淀,说明溶液中含有碳酸钠;
②静置后取上层清液滴入硫酸铜溶液又产生蓝色沉淀,说明溶液中含有氢氧化钠,根据以上现象他们能得出该氢氧化钠溶液中溶质的成分是碳酸钠和氢氧化钠,他们加入足量的氯化钙溶液的作用是使碳酸钠完全反应,该步反应方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl.
故填:碳酸钠和氢氧化钠;使碳酸钠完全反应;Na2CO3+CaCl2═CaCO3↓+2NaCl.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
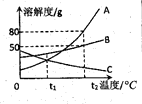 A、B、C三种固体物质的溶解度曲线如图所示,据图回答问题:
A、B、C三种固体物质的溶解度曲线如图所示,据图回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | HCl+NaOH═NaCl+H2O | D. | Cu+2AgNO3═2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
| 方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 纤维素是由C、H、O三种元素组成的 | |
| B. | 棉线与羊毛线可用燃烧的方法区别 | |
| C. | 纤维素中C、H、O三种元素的原子个数比为6:10:5 | |
| D. | 纤维素中C、H、O三种元素的质量比为12:1:16 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 馒头或面条 | B. | 酸牛奶 | C. | 蔬菜、水果 | D. | 鸡蛋. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com