
【题目】下图所示是实验室制取气体的部分装置,请回答下列问题:
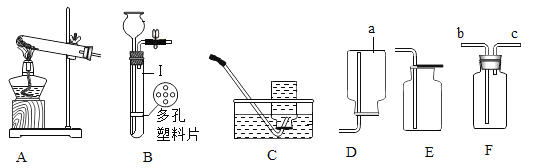
(1)写出仪器a的名称________。
(2)欣悦同学用装置B制取氧气,请写出该原理的化学方程式:________________________,该反应发生装置的优点是______________。
(3)若选用装置F用排空气法收集氢气,气体应从________(填“b”或“c”)端进入。
科目:初中化学 来源: 题型:
【题目】如图所示,锌片,铜片,硫酸铜溶液,连接上电表,一段时间之后,关于实验现象,下列说法不正确的是
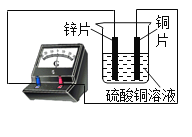
A.锌极表面出现红色物质
B.铜表面增厚
C.电流表读数不为零,显示出电路中铜极到锌极的电流
D.这个装置可实现化学能转化为电能
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】X、Y两种固体物质的溶解度曲线如图所示。下列说法正确的是_____
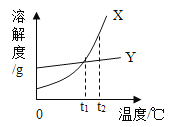
A两种物质的溶解度X>Y
B t2℃时,两种物质的饱和溶液中溶质的质量分数X>Y
C将t1℃时Y的饱和溶液升温至t2℃,溶质的质量分数增大
D若X中混有少量的Y,提纯X宜采用的方法是_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镀铬金属既漂亮又耐腐蚀,为了解金属铬的相关性质同学们进行了如下探究活动。
[查阅资料]
资料1:铬是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。
资料2:铬在发生置换反应时生成Cr2+,含有Cr2+的溶液常显蓝色。
[实验药品]铝片、铬片、铜片、稀硫酸、稀盐酸、CrSO4 溶液。
[实验过程]
(1)彬彬同学取大小相同的铝片、铬片和铜片,准备浸入到盛有相同质量分数的稀硫酸的三根试管中观察现象,三种金属片放入稀硫酸前要进行预处理是_____。
记录现象如下:
试管1 | 试管2 | 试管3 | |
实验现象 | 金属片表面产生气泡缓慢,溶液逐渐变蓝色 | 金属片表面产生气泡较快 | |
实验结论 | 三种金属的金属活动性由强到弱的顺序为_____。( 填元素符号) | ||
写出试管1中发生反应的化学方程式_____。
(2)明明从上面给定的实验药品中选了三种药品进行实验,也得出了上述三种金属的活动性强弱,则他选用的三种实验药品是_____,实验中发生反应的化学方程式为_____。
[学以致用]
(3)彬彬同学了解到某电镀厂废水中含有AgNO3、Cu(NO3)2 和Cr(NO3)2,为了从中回收贵重金属银和一种盐晶体,他设计如下图实验流程:
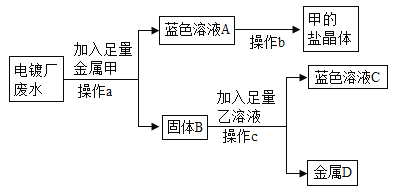
请回答:操作a加入足量的金属甲为_____,反应前固体B质量_____(填“大于”、 “小于”或“等于”)反应后固体D的质量。
[知识拓展]
(4)工业上可利用“铝热反应”来冶炼铬,其原理是在高温下用铝将铬从其氧化物(Cr2O)中置换出来。若要制得780kg铬,理论上至少需要铝的质量是多少_____?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~G是初中化学常见物质,各物质转化关系如图所示(“→”表示转化关系,“﹣”表示互相反应,反应条件、部分反应物和生成物已省略),其中D和F组成元素相同。
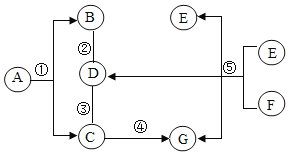
(1)物质A的化学式为_____。
(2)反应③的化学方程式为_____。
(3)图中的分解反应有_____(填序号)。
(4)根据反应②,B物质可以在实验室或生活中作_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知4FeS2+11O2![]() 2Fe2O3+8X,则下列关于该反应说法错误的是
2Fe2O3+8X,则下列关于该反应说法错误的是
A. O2与X的相对分子质量之比为1∶2
B. 该反应属于置换反应
C. X属于空气污染物之一
D. 该反应中硫元素的化合价升高
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电解法是工业上制铜的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为:2CuSO4+2H2O ![]() 2Cu↓+O2↑+2H2SO4,取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)回答下列问题:
2Cu↓+O2↑+2H2SO4,取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6gCu.(注:本题不考虑气体在溶液中的溶解)回答下列问题:
(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)____________
(2)向电解后得到的488.0g溶液中加入一定量的某种物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的_____(填选项编号)。
A Cu B CuO C Cu(OH)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一段去除氧化镁的镁条放入一定量的盐酸中,有气泡产生,充分反应后静置,发现试管中有白色沉淀产生。为探究白色沉淀的成分,九(1)班兴趣小组同学在老师的指导下进行如下实验:
试管(盛有等体积等浓度的盐酸) | ① | ② | ③ | ④ |
镁条质量(g) | 1 | 1.5 | 2 | 2.5 |
实验现象 | 快速反应,试管发热,镁条全部消失 | |||
白色沉淀量(恢复至20°C) | 无 | 少量 | 较多 | 很多 |
(1) 4支试管中盛有等体积等浓度的盐酸的原因___________________。
[得出结论]
(2)镁条与盐酸反应产生白色沉淀的量与_________________有关。
[提出问题]
白色沉淀是什么物质?
[查阅资料]
在氯化镁溶液中,镁能与水常温下反应生成氢氧化镁和氢气。
[猜想与假设]
甲:白色沉淀可能是碳酸镁
乙:白色沉淀可能是生成的氯化镁增多析出的晶体
丙:白色沉淀可能是剩余的镁
丁:白色沉淀可能是氢氧化镁
(3)其他同学认为甲的猜想是错误的,原因是_________________。
[实验验证]
序号 | 操作步骤 | 实验现象 | 结论 |
1 | 取第一份白色不溶物于试管中,加入蒸馏水,震荡 | (4)沉淀____________溶解(选填会或不会) | 乙同学猜想不成立 |
2 | 取第二份白色不溶物于试管中,加入稀盐酸 | (5)___________________ | 丙同学猜想不成立 |
3 | ①取第三份白色不溶物于试管中,加入稀硝酸 ②向所得溶液加入几滴硝酸银溶液 | ①白色沉淀不溶解 ②出现大量白色沉淀 | ①丁同学猜想不成立 ②白色不溶物定含 (6)____________元素 |
[实验结论]
在老师的帮助下,同学们得出白色沉淀物是Mg2(OH)2Cl2,反应的化学方程式为2Mg+2HCl+2H2O=Mg2(OH)2Cl2+2H2![]() 。
。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组测定某工业废水(含有H2SO4、HNO3,不含固体杂质)中H2SO4的含量。取100g废水于烧杯中,加入100gBaCl2溶液,恰好完全反应,经过滤得到176.7g溶液。(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)
(1)充分反应后生成沉淀的质量为________________g。
(2)该工业废水中硫酸的质量分数为_______________。(写出计算过程,计算结果精确到0.1%;方程式:![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com