
分析 【问题分析】(1)根据盐酸和氢氧化钠反应生成氯化钠和水进行分析;
(2)根据氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠进行分析;
(3)根据氢氧化钙、碳酸钠、氢氧化钠溶液显碱性,能使酚酞变红色进行分析;
【实验验证】①根据氯化钙和碳酸钠反应胡思陈碳酸钙沉淀和氯化钠进行分析;
②根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析.
解答 解:【问题分析】(1)盐酸和氢氧化钠反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H2O;
(2)氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)氢氧化钙、碳酸钠、氢氧化钠溶液显碱性,能使酚酞变红色,所以澄清液显红色,说明该澄清液显碱性,其中溶质除一定有NaOH外,还可能含有碳酸钠或氢氧化钙;
【实验验证】①氯化钙和碳酸钠反应会生成碳酸钙沉淀和氯化钠,所以取澄清液,加入适量的CaCl2溶液,无明显现象,则澄清液中不含碳酸钠;
②二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.
故答案为:【问题分析】(1)NaOH+HCl=NaCl+H2O;
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)碳酸钠,氢氧化钙;
【实验验证】①碳酸钠;
②CO2+Ca(OH)2=CaCO3↓+H2O.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
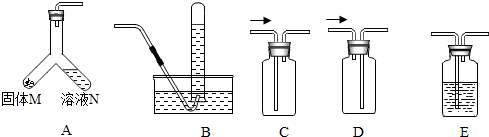
| 固体M | 溶液N | 制取的气体 | 收集装置(填字母) |
| 大理石 | CO2 | ||
| 锌粒 | 稀硫酸 | B或D | |
| O2 | B或C |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氮气 | B. | 氧气 | C. | 二氧化碳 | D. | 水蒸气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 把pH试纸浸入待测液 | |
| B. | 用湿润的玻璃棒蘸取待测液 | |
| C. | 把显色的pH试纸与标准比色卡对照读数 | |
| D. | 测出石灰水的pH为12.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气的主要成分是氮气和氧气 | |
| B. | 生活中可用煮沸的方法来降低水的硬度 | |
| C. | 蛋白质是人体所需的基本营养素之一 | |
| D. | 随意丢弃废旧电池,不会造成环境污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
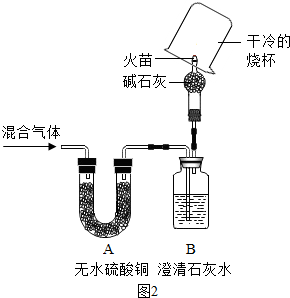 某化学兴趣小组对水蒸气通过灼热的焦炭后,得到的混合气体主要成分产生了兴趣.同学们决定通过实验进行探究.
某化学兴趣小组对水蒸气通过灼热的焦炭后,得到的混合气体主要成分产生了兴趣.同学们决定通过实验进行探究.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com