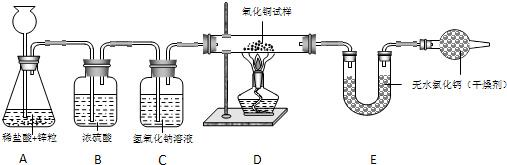
解:(1)仪器A中发生反应的化学方程式为:Zn+2HCl═ZnCl
2+H
2↑.
(2)装置C的作用是吸收氯化氢气体.故填:吸收氯化氢气体.
氢氧化钠和氯化氢反应的化学方程式为:NaOH+HCl═NaCI+H
2O.
(3)仪器D中的实验现象是:黑色固体逐渐变成红色,玻璃管壁上出现水珠.故填:黑色固体逐渐变成红色,玻璃管壁上出现水珠.
发生反应的化学方程式为:H
2+CuO

Cu+H
2O.
(4)由于吸收氯化氢气体是使用氢氧化钠溶液,导致得到的气体中混有水蒸气,导致计算出的结果和实际值相比将偏大.故填:偏大.
(5)此实验的不足一是不应该先干燥后除杂,二是利用生成水被吸收的质量来测定容易差生很大的误差.所以改进可以注意这两点.针对该实验装置,改进意见是:将BC的试剂顺序换过来;改为称量D中反应前后固体质量差的方法来计算试样中氧化铜的质量分数.
分析:(1)锌和盐酸反应能生成氯化锌和氢气;
(2)氢氧化钠溶液能吸收氯化氢气体;
(3)氢气和氧化铜在加热条件下反应能生成水和铜;
(4)由于吸收氯化氢气体是使用氢氧化钠溶液,导致得到的气体中混有水蒸气,导致计算出的结果和实际值相比将偏大;
(5)装置不应该先干燥后除杂,通过称量D中反应前后固体质量差的方法来计算试样中氧化铜的质量分数不会产生偏差.
点评:本题主要考查氢气还原氧化铜、书写化学方程式等方面的知识,书写化学方程式时要注意遵循质量守恒定律.


 Cu+H2O.
Cu+H2O.