
| 实验步骤 | 实验现象 | 实验结论 |
| 1将NaOH溶液稀释,滴人该酚酞溶液. | 溶液变红,继续滴加酚酞溶液,红色消失 | 甲同学猜想不正确 (填“正确”或“不正确”) |
| 2向澄清石灰水中滴入该酚酞溶液 |
分析 (1)分析实验操作,判断探究的实验目的;
(2)根据NaOH溶液与空气中的C02发生反应生成碳酸钠,碳酸钠溶液呈碱性解答;
(3)根据改变NaOH溶液浓度设计实验探究问题;
(4)根据题中信息分析解答;
(5)根据盛酚酞溶液的试剂瓶之前盛过酸溶液没有洗净,利用酸碱中和的原理分析解答.
解答 解:(1)向加有无色酚酞的氢氧化钠溶液中滴加稀硫酸,至红色消失;此操作说明在探究酸与碱能否发生的中和反应;反应的化学方程式:H2SO4+2NaOH═Na2SO4+2H2O;
(2)NaOH溶液与空气中的C02发生反应生成碳酸钠,反应的化学方程式:2NaOH+CO2═Na2CO3+H2O; 反应生成的碳酸钠溶液显碱性,能使酚酞变红,不可能是NaOH溶液与空气中的C02发生了反应;
(3)将NaOH溶液稀释,滴人该酚酞溶液.向澄清石灰水中滴入该酚酞溶液,二者溶液变红,继续滴加酚酞溶液,红色消失,说明红色褪去的现象与碱溶液无关;
(4)丙同学根据甲同学的实验结果推测红色褪去的现象与碱溶液无关,可能是所用酚酞溶液的问题.于是他查阅资料,发现酚酞溶液是一种弱有机酸,他又向原氢氧化钠溶液中持续滴加若干滴新配制的酚酞溶液,结果发现溶液变红后并没有消失.这说明酚酞溶液本身微弱的酸性应该不是乙同学实验红色消失的主要原因.
(5)盛酚酞溶液的试剂瓶之前盛过酸溶液没有洗净.取乙同学所用酚酞溶液少许,逐滴滴加氢氧化钠溶液,观察现象.若开始滴加氢氧化钠溶液时无现象,继续滴加后出现红色且不再消失.即可证明.
答案:
(1)酸和碱发生的中和反应,H2SO4+2NaOH═Na2SO4+2H2O;
(2)反应生成的碳酸钠溶液显碱性,能使酚酞变红.2NaOH+CO2═Na2CO3+H2O;
(3)不正确;
(4)不是;
(5)盛酚酞溶液的试剂瓶之前盛过酸溶液没有洗净.取乙同学所用酚酞溶液少许,逐滴滴加氢氧化钠溶液,观察现象.若开始滴加氢氧化钠溶液时无现象,继续滴加后出现红色且不再消失.即可证明.
点评 本题考查了如何探究物质的性质和变化规律,掌握反应现象与本质的联系、学会猜想和事实验证的方法是解题的关键.


科目:初中化学 来源: 题型:选择题
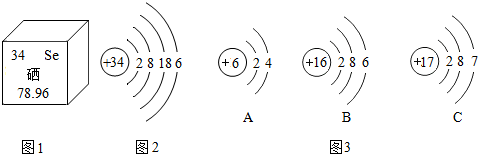
| A. | 硒是人体必需的微量元素 | |
| B. | 由图1可知,硒元素的相对原子质量是78.96 | |
| C. | 图3中A、B、C三种元素中与硒元素化学性质相似的是A元素 | |
| D. | 图3中C元素原子在化学反应中容易得到电子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
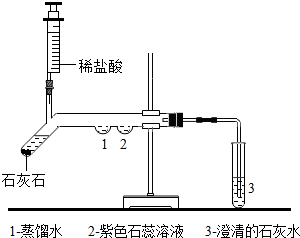 学习了二氧化碳的性质后,小科设计了如图所示的实验进行验证:
学习了二氧化碳的性质后,小科设计了如图所示的实验进行验证:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交 | |
| B. | 在20℃时,向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18% | |
| C. | 分别将20℃时的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中 溶质的质量分数大于氯化钠溶液 | |
| D. | 从含有少量硝酸钾的饱和氯化钠溶液中得到较多的氯化钠晶体,通常可采用蒸发溶剂使其结晶的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com