
(本题包括1小题,共12分)
27.(11分)四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2 Na2S4 + O2 + 2H2O = 8S↓+ 4 NaOH。
【实验资料】
①四硫化钠(Na2S4)的相对分子质量为 ,其中硫元素的质量分数为 (结果精确到0.1%)。
②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体
④硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
【实验过程】
①取碳酸钠、 硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得Na2S4,反应为4Na2CO3 + 12S + X  2
Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为
,蘸有浓NaOH 溶液的棉花的作用是
。
2
Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为
,蘸有浓NaOH 溶液的棉花的作用是
。
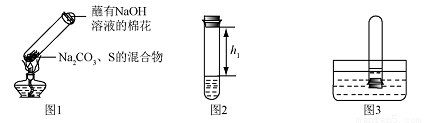
②冷却后,取下棉花,放置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),取下橡胶塞,观察到
,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=
④按照①~③再重复实验2次.3次实验数据如下表所示。
|
|
第1次 |
第2次 |
第3次 |
|
h1/cm |
11.2 |
11.4 |
11.6 |
|
h2/cm |
8.9 |
9.1 |
9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为 (结果精确到0.1%)。
【反思与评价】(1)若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,会影响测定结果,请说明有何影响,并阐述理由: 。(2分)
(2)若要保证实验的效果,至少需要生成四硫化钠(Na2S4)0.174g ,则理论上实验时至少取碳酸钠粉末 克?写出计算过程(2分)
【实验资料】 174; 73.6%
【实验过程】 O2 ;吸收二氧化碳和Na2S4受热产生的有毒气体硫化氢
 有淡黄色固体产生,试管内液面上升; 5 :4
有淡黄色固体产生,试管内液面上升; 5 :4
【解释与结论】 20.5%
【反思与评价】
(1)若未放置一段时间,结果将偏小;因为第一步反应消耗了试管空气中的氧气,若不静置第二步反应中氧气含量偏低,测量结果偏小。
(2)0.212g
【解析】
试题分析:
【实验资料】相对分子质量指分子中原子的相对原子质量之和,四硫化钠(Na2S4)的相对分子质量为23×2+32×4=174。硫元素的质量分数指化合物中硫元素质量占整个化合物质量的百分数。列式为:(32×4/174)×100%=73.56%,题目要求精确到0.1%,结果为73.6%。
【实验过程】①根据质量守恒定律,反应前后原子的种类、数目、质量不变。所以X的化学式为O2。根据4Na2CO3 + 12S + X  2
Na2S4+ 2 Na2S2O3 + 4CO2,碳酸钠、 硫粉混合后置于试管中,加热会产生CO2,根据【 实验资料】②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢,③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体。综合可知,氢氧化钠溶液的作用应该是吸收二氧化碳、硫化氢等气体。
2
Na2S4+ 2 Na2S2O3 + 4CO2,碳酸钠、 硫粉混合后置于试管中,加热会产生CO2,根据【 实验资料】②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢,③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体。综合可知,氢氧化钠溶液的作用应该是吸收二氧化碳、硫化氢等气体。
③冷却后,试管中固体为Na2S4和 Na2S2O3 ,再加入水,根据2 Na2S4 + O2 + 2H2O = 8S↓+ 4 NaOH可知,生成淡黄色物质硫,试管中的空气中的氧气被消耗,再倒插入水中,试管中的水面会上升。所以本题答案为:有淡黄色固体产生,试管内液面上升。h1实质是空气的体积,h2是把氧气消耗后剩余气体的体积,实际上主要是氮气的体积,所以h1 :h2=5:4
【解释与结论】根据第1次实验数据,氧气体积为11.2-8.9=2.3,空气体积为11.2,所以氧气的体积分数为2.3/11.2×100%=20.5%
【反思与评价】
(1)若未放置一段时间,结果将偏小;因为第一步反应(碳酸钠、 硫粉混合后置于试管中加热)消耗了试管空气中的氧气,若不静置第二步反应中氧气含量偏低,测量结果偏小。
(2)此题为根据化学方程式的计算。计算时依据化学方程式的含义——表示各物质的质量比进行计算。具体解题过程为:
解:设需要碳酸钠的质量为x
4Na2CO3 + 12S + X  2
Na2S4+ 2 Na2S2O3 + 4CO2
2
Na2S4+ 2 Na2S2O3 + 4CO2
424 348
x 0.174g
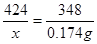
x=0.212g
考点:化学式的计算,质量守恒定律,根据化学方程式的计算,空气中氧气含量的测定,实验设计及分析。


 阅读快车系列答案
阅读快车系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com