
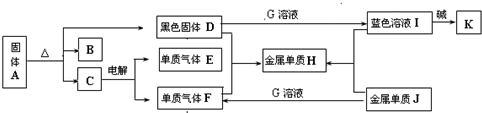
某溶液中含有Cu(NO2)2、Ba(NO3)2、AgNO3三种溶质,为使上述三种物质分别一一转化为沉淀,并将沉淀一一分离出来,现提供Na2CO3溶液、稀盐酸和NaOH溶液三种试剂,要求每次只加一种试剂滤出沉淀,那么所加试剂的先后顺序是________、________、________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
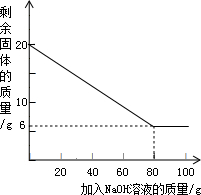 已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2A1+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究.资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2A1+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验操作 | 实验现象 | 结论 |
| Ⅰ取少量的金属粉末于试管中,加入足量的________________(填试剂名称). | _____________. | 仅除去铝 |
| Ⅱ将试管静置,弃去上层清液,加入足量的稀硫酸. | _____________. | 证明含有铁 |
| Ⅲ将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
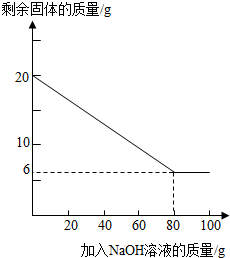
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 16.5 | n | 9.5 | … |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
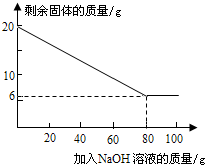 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加 足量(或过量)的NaOH溶液 足量(或过量)的NaOH溶液 ,充分反应后,静置,弃去清液得到固体. |
固体粉末 部分溶解 部分溶解 ,有 气泡放出 气泡放出 . |
仅除去铝 |
| ② | 再往大试管中加 足量(或过量)的稀硫酸(或稀盐酸) 足量(或过量)的稀硫酸(或稀盐酸) ,充分反应. |
固体 部分溶解并有气泡放出 部分溶解并有气泡放出 ,溶液 呈浅绿色 呈浅绿色 . |
证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com