
分析 鉴别物质时,首先对需要鉴别的物质的性质进行对比分析找出特性,再根据性质的不同,选择适当的试剂,出现不同的现象的才能鉴别.
解答 解:(1)氢氧化钾溶液呈碱性,能使紫色石蕊试液变蓝色;氯化钠溶液呈中性,不能使紫色石蕊试液发生颜色改变,仍为紫色;稀硫酸呈酸性,能使紫色石蕊试液变成红色;滴加石蕊试液时,三种溶液能出现明显不同的现象,故利用石蕊可以鉴别三种溶液;故填:紫色的石蕊试液;
(2)Na2CO3与稀盐酸反应产生二氧化碳气体,与石灰水反应产生碳酸钙白色沉淀,与KOH溶液不反应;分别滴加Na2CO3溶液,产生气泡的是稀盐酸,产生白色沉淀的是石灰水,无明显变化的是KOH溶液;能出现三种明显不同的现象,故可以鉴别;故填:碳酸钠溶液;
(3)食盐溶于水温度几乎不变,硝酸铵溶于水会使温度明显降低,而氢氧化钠溶于水会使温度明显升高,现象不同,可以鉴别;故填:蒸馏水.
点评 本题有一定难度,在解决鉴别物质题时,判断的依据是:所选试剂需要与待鉴别的物质反应并出现明显不同的现象.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
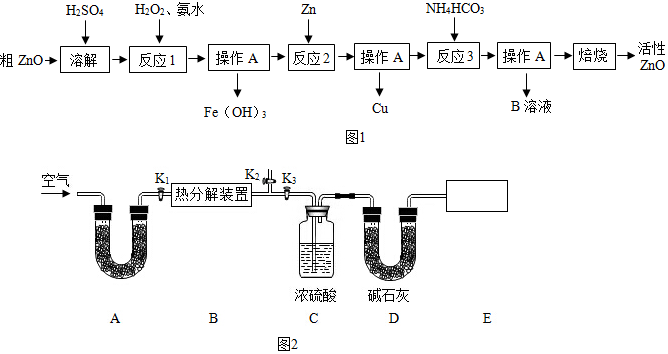
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com