
【题目】下列有关量的变化图像与其对应叙述不相符的是
A.  红磷燃烧装置内压强变化
红磷燃烧装置内压强变化
B.  往 盐 酸 与 氯 化 铁混合溶液中加入氢 氧化钠溶液
往 盐 酸 与 氯 化 铁混合溶液中加入氢 氧化钠溶液
C.  浓盐酸、浓硫酸敞口放置于空气中
浓盐酸、浓硫酸敞口放置于空气中
D. 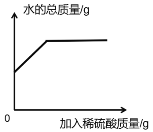 往氢氧化钡溶液中 加入稀硫酸溶液
往氢氧化钡溶液中 加入稀硫酸溶液
【答案】D
【解析】
A、红磷燃烧放热,装置内压强变大,燃烧结束并冷却到室温后,由于气体的量减少,压强变小,小于原来的压强,选项正确;
B、往盐酸与氯化铁混合溶液中加入氢氧化钠溶液,氢氧化钠先与盐酸反应生成氯化钠和水,所以开始氯化铁不减少,盐酸完全反应后,加入的氢氧化钠再与氯化铁反应,最终氯化铁会完全反应减少至零,选项正确;
C、浓盐酸有挥发性,敞口放置时溶液质量减少,浓硫酸有吸水性敞口放置于空气中,因吸水,溶液质量增加,选项正确;
D、往氢氧化钡溶液中加入稀硫酸溶液,氢氧化钡和硫酸反应生成硫酸钡和水,水的量增加,完全反应后,因稀硫酸中有水,所以在加入稀硫酸的过程中,水的量应仍然增加,选项错误。
故选D。


科目:初中化学 来源: 题型:
【题目】分析甲、乙两种固体的溶解度曲线,回答问题:
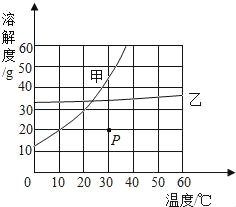
(1)在10℃时将25g甲放入100g水中,充分搅拌后,能够观察到_____,由此可知,此状态下该溶液是饱和溶液;
(2)P点为30℃时甲的不饱和溶液,欲将其转化为饱和溶液,除可采用恒温蒸发一定量的水,加入一定量甲之外,还可采取用的方法是_____;
(3)若从甲物质的饱和溶液中全部回收甲物质,应采用的结晶方法是_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某粗盐中除NaCl以外还含有少量杂质MgCl2,为了测定粗盐中MgCl2的质量分数。取固体样品50.0g完全溶解于150.0g水中,并向其中逐渐加入一定浓度的NaOH溶液,实验过程中生成沉淀的质量与加入NaOH溶液的质量的关系如图所示:

注:发生反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl
请根据相关信息完成下列计算:
(1)反应完全时,生成氢氧化镁的质量为_____g;
(2)在粗盐中氯化镁的质量分数;_____
(3)恰好完全反应时得到的溶液中溶质的质量分数。_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学基础与常识。
(1)空气中二氧化碳的体积分数为____。
(2)高铁酸钠(Na2FeO4)是一种新型高效的净水剂,标出高铁酸钠中铁元素的化合价______。自来水厂对天然水净化处理得到自来水的过程中,下列操作:①过滤;②吸附;③消毒;④蒸馏,没有用到的是____。(填序号)
(3)过氧化钙晶体﹝CaO2·8H2O﹞较稳定,呈白色,微溶于水,广泛应用于环境杀菌、消毒。以贝壳为原料制备CaO2流程如下:
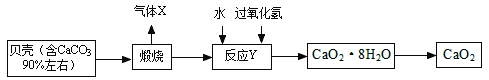
反应Y是化合反应,请写出其化学方程式____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有铜与金属X组成的混合物粉末,金属X是镁、铁、锌中的一种.利用该混合物进行如下实验:
实验步骤及数据:取该混合物粉末8.0g放入烧杯中,将140.0g 溶质质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得烧杯内剩余固体的质量数据如下表:
加入稀硫酸的次数 | 第1次 | 第2次 | 第3次 | 第4次 |
烧杯内剩余固体质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
实验通过计算,求:
(1)该混合物粉末中铜的质量分数为_____;
(2)该混合物是由铜粉和_____组成的;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?_____(写出计算过程)
(4)若用溶质的质量分数为98%、密度为1.84g/cm﹣3的浓硫酸来配制本实验中所用的稀硫酸,则需要取浓硫酸多少毫升?_____同时加入水多少毫升?_____(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O===2Ca(OH)2+O2↑。某同学把20g不纯的过氧化钙样品(杂质不与水反应)加入到盛有50g水(足量)的烧杯中,完全反应后,称量烧杯内物质的总质量为66.8g。请计算:
(1)生成氧气_____g;
(2)该样品中过氧化钙的质量分数_____。(根据化学方程式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是国际通用语言,请用化学用语填空:
(1)铝元素_____;(2)1个硅原子_____;
(3)2个二氧化氮分子_____;(4)镁离子_____;
(5)硝酸银离子_____;(6)标出KClO3中氯元素的化合价_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20 ℃时,取18 g KNO3和18 g NaCl分别放入两只烧杯中,各加入50 mL水(水的密度为1 g/mL),充分溶解,现象如图甲所示;升温到50 ℃时,现象如图乙所示。KNO3和NaCl的溶解度曲线如图丙。请回答下列问题:
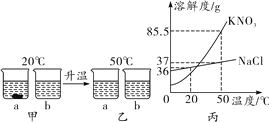
(1)a烧杯中加入的物质是______(填化学式)。
(2)甲图中,a烧杯溶液中溶质的质量分数______(“>”、“<”或“=”)b烧杯溶液中溶质的质量分数。
(3)要使乙图中的NaCl溶液恰好变成饱和溶液,需要加入________g NaCl固体。
(4)除去NaCl固体中混有的少量KNO3,实验步骤:先加水溶解,再________,然后过滤、洗涤、干燥。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为元素周期表中某一周期元素的原子结构示意图。
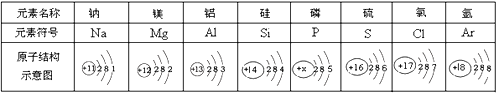
请回答下列问题:
(1)表中磷原子的核电荷数x=__________.
(2)表中具有相对稳定结构的元素是___________.
(3)一个铝离子的符号是____________,若某种铝原子的相对原子质量为27,则它的中子数为__________.
(4)上述元素原子的共同点是____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com