解:(1)由题可知地壳里含量最高的是金属铝,但铝开发利用的时间在后,说明金属大规模开发、利用的先后顺序与地壳里金属含量无关,同时与金属的导电性和延展性也无关,而是与金属活动性顺序和金属冶炼的难易程度有关;
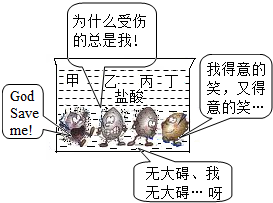
(2)由题意可知四种金属的活动性强弱顺序为:甲>乙>丙>(H)>丁,因此丙不可能为铜;
(3)反应物为氢气和氯化亚铁,生成物是铁和氯化氢,反应的化学方程式为H
2+FeCl
2
2HCl+Fe,纳米铁在高温下与空气中的氧气发生反应,因此反应中需要保护气;
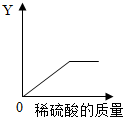
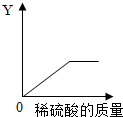
(4)向一定量的铁粉中逐滴加入稀硫酸至过量,消耗铁粉的质量、生成硫酸亚铁的质量、生成氢气的质量都是先增加,随着铁粉的反应完全它们的质量不再增加;溶液的总质量是不断增加的;
(5)铜、铁均能与FeCl
3溶液反应,充分反应后烧杯中仍有少量固体,说明FeCl
3不再存在,溶液中一定含FeCl
2;铁能与氯化铜溶液反应,因此溶液中可能没有氯化铜,铁不剩余;
故答案为(1)③;
(2)③;
(3)H
2+FeCl
2
2HCl+Fe;防止生成的纳米铁在高温下与空气中的氧气发生反应
(4)③
(5)②
分析:金属的活动性顺序的应用主要表现在两个方面:一是只有排在氢前面的金属才能与酸发生置换反应,生成盐和氢气;二是只有排在前面的金属才能把后面的金属从它的盐溶液中置换出来;化学方程式的书写主要做好以下几个方面:反应物、生成物、反应条件、化学式的书写、配平、沉淀气体的标注等.
点评:本题主要是让我们结合生活常识和所学知识,探究日常生活中常见金属及其制品的物理和化学性质,涉及知识面比较广泛.包括:金属活动顺序表、金属的金属活动性强弱、金属性越强的金属与酸反应速率越快、排在前面的金属可以将排在后面的金属从它们的金属溶液中置换出来、金属的化学性质等.


 2HCl+Fe,纳米铁在高温下与空气中的氧气发生反应,因此反应中需要保护气;
2HCl+Fe,纳米铁在高温下与空气中的氧气发生反应,因此反应中需要保护气; 2HCl+Fe;防止生成的纳米铁在高温下与空气中的氧气发生反应
2HCl+Fe;防止生成的纳米铁在高温下与空气中的氧气发生反应


 人类的生活离不开金属材料
人类的生活离不开金属材料