
分析 (1)根据生石灰溶于水生成熟石灰和测定溶液pH的操作方法分析;
(2)石灰浆刷墙壁,涉及到的反应是氢氧化钙和二氧化碳反应;
(3)氢氧化钙与硫酸反应生成硫酸钙和水.
(4)①根据氢氧化钙与碳酸钾反应生成碳酸钙和氢氧化钾解答;
②根据植物需要的营养元素有N、P、K,“黑白粉”中含有K元素解答.
解答 解:(1)生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.
(2)石灰浆中的主要成分是氢氧化钙,能与空气中的二氧化碳反应生成碳酸钙和水;碳酸钙是一种不溶于水的白色的坚硬的物质,干燥后墙面变得既白又硬,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(3)氢氧化钙与硫酸反应生成硫酸钙和水,反应的化学方程式为:Ca(OH)2+H2SO4═CaSO4+2H2O.
(4)①氢氧化钙与碳酸钾反应生成碳酸钙和氢氧化钾,化学方程式为:Ca(OH)2+K2CO3=CaCO3↓+2KOH;
②植物需要的营养元素有N、P、K,“黑白粉”中含有K元素.
故答案为:(1)CaO+H2O═Ca(OH)2.用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,(2)CO2+Ca(OH)2═CaCO3↓+H2O.(3)Ca(OH)2+H2SO4═CaSO4+2H2O(4)①Ca(OH)2+K2CO3=CaCO3↓+2KOH;②K.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力等,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.


科目:初中化学 来源: 题型:实验探究题
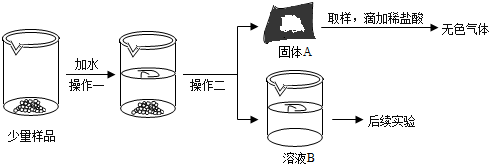
| 实验目的 | 实验步骤 | 实验现象 | 实验结论 |
检验溶液B中溶质的存在 | ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 | ①有白色沉淀生成 ②溶液由无色变为红色 | 猜想③ 正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| R | O2 | CO2 | H2O | |
| 反应前质量/g | 46 | 128 | 0 | 0 |
| 反应后质量/g | 0 | 32 | x | 54 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | |
| A. | NaCl的溶解度比KNO3的溶解度大 | |
| B. | 两种物质溶解度相等的温度在20℃~30℃之间 | |
| C. | 20℃时,NaCl的溶解度为36.0g | |
| D. | 60℃时,将11gKNO3加入10g水中充分溶解,溶液刚好饱和 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 预期现象和必要结论 |
| 步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤 | / |
| 步骤2:取少量步骤1所得的滤液于试管中,向其中加入足量的稀盐酸,振荡,观察现象.. | 有气泡生成 |
| 步骤3:向步骤2反应后溶液中滴入少量的BaCl2溶液,观察现. | 若有白色沉淀生成,说明样品中有ZnSO4; 若无明显现象,说明样品中没有ZnSO4. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
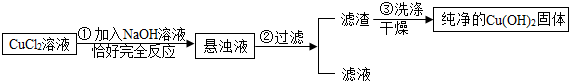
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com