
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片和铜片,稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序。
(1)实验前,用砂纸打磨金属片的目的是: ;
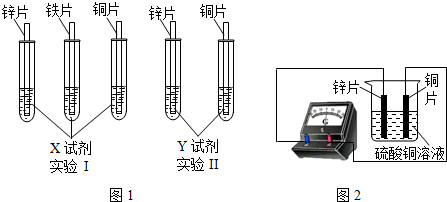
(2)根据实验目的,该同学设计了实验Ⅰ、Ⅱ两中合理的方案,如图所示:
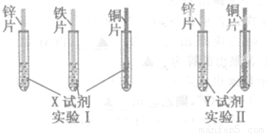
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现为青色。
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色。
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,以检验其组成为铁和铜。粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
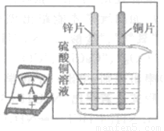
(4)如图所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 。
(1)除去金属表面的氧化物(或污物);
(2)H2SO4 FeSO4;
(3)A.浅绿。
B.①FeSO4+Zn=ZnSO4+Fe;
②铜和锌构成原电池、电子转移过程中亚铁离子得到电子变成铁单质;
(4)①指针发生偏转; ②变粗。
【解析】
试题分析:(1)放置在空气中的金属其表面会因与空气反应生成其氧化物。所以在金属片使用前应将这层金属的氧化物用砂纸打磨除去。
(2)从图中可知,要通过与X的现象验证三种金属的活动性顺序,要求X应最少与三种金属中的两种较活泼的都反应,所以X应为H2SO4。
Y与锌、铜两种金属接触后可得知三种金属的活动性顺序,因此Y应为含铁的盐。所以Y为FeSO4。
(3)A锌的活动性比铁与铜都强,所以锌会与硫酸铜先发生反应生成硫酸锌(无色)。当硫酸铜恰好反应完全时,溶液中含硫酸亚铁(浅绿色)和硫酸锌。剩余的锌再与硫酸亚铁反应,当硫酸亚铁全部反应时,溶液中只含硫酸锌,此时溶液为无色。
B溶液为青色,说明硫酸铜还未完全参与反应。因此铁出现的原因是:铜和锌构成原电池、电子转移过程中亚铁离子得到电子变成铁单质;发生的反应为:FeSO4+Zn=ZnSO4+Fe
(4)用导线将锌片和铜片连接起来,铜和锌会构成原电池。接入电流表,由于产生电流的原因,会发现电流表指针发生偏转。随着反应的发生,铜片表面会逐渐附着反应生成的铜,
考点:金属的化学性质
点评:正确运用金属的化学性质进行解答。


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:
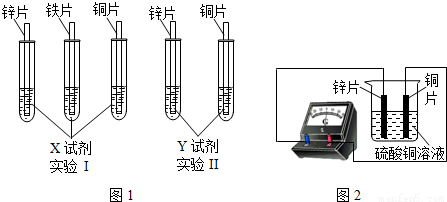
某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,验证锌、铁、铜的金属活动性顺序.
(1)实验前,用砂纸打磨金属片的目的是 ;
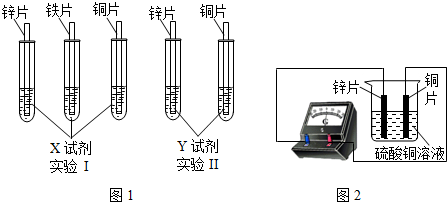
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合弹的方案,如图l所示:
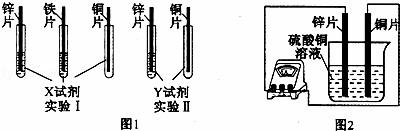
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,溶液呈现青色.
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化应为:青色变浅至 色,最终变为无色;
B.向混合注中插人锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜.粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
② ;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:①电流表 ;②铜片表面 .
查看答案和解析>>
科目:初中化学 来源:2013年江苏省常州市中考化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com