
| A. | 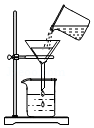 | B. | 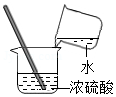 | C. | 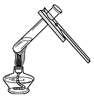 | D. | 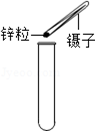 |
分析 A、过滤液体时,注意“一贴、二低、三靠”的原则.
B、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
C、根据给试管中的液体加热的方法进行分析判断.
D、根据向试管中装块状或颗粒状固体药品的方法(“一横、二放、三慢竖”)进行分析判断.
解答 解:A、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误.
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作错误.
C、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的$\frac{1}{3}$,图中所示操作正确.
D、向试管中装锌粒时,先将试管横放,用镊子把锌粒放在试管口,再慢慢将试管竖立起来,图中所示操作错误.
故选:C.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.


科目:初中化学 来源: 题型:解答题
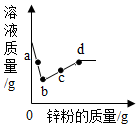 向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请分析a点时溶液中有哪些溶质?c点时过滤能得到哪些固体?b~d段溶液质量增加的原因是什么?
向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如图,请分析a点时溶液中有哪些溶质?c点时过滤能得到哪些固体?b~d段溶液质量增加的原因是什么?查看答案和解析>>
科目:初中化学 来源: 题型:推断题
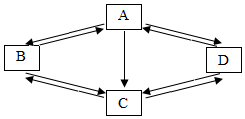 已知A、B、C、D是初中化学中常见的物质.它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略).A是一种温室效应的主要气体,B是单质.D在常温下不稳定易分解.
已知A、B、C、D是初中化学中常见的物质.它们之间的部分转化关系如图所示(图中反应条件及部分反应物、生成物已省略).A是一种温室效应的主要气体,B是单质.D在常温下不稳定易分解.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | CO2和SO2都能和NaOH溶液反应,CO也能和NaOH溶液反应 | |
| B. | CO和C都能和CuO反应生成Cu,有还原性,H2也能相CuO反应生成Cu,也有还原性 | |
| C. | 活泼金属和盐酸反应生成气体,和盐酸反应生成气体的物质不一定是活发金属 | |
| D. | 氢氧化钙和氢氧化钠都属于碱,都含有金属元素,所以碱都含有金属元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
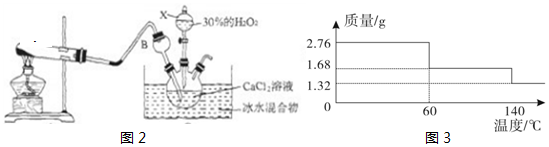
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
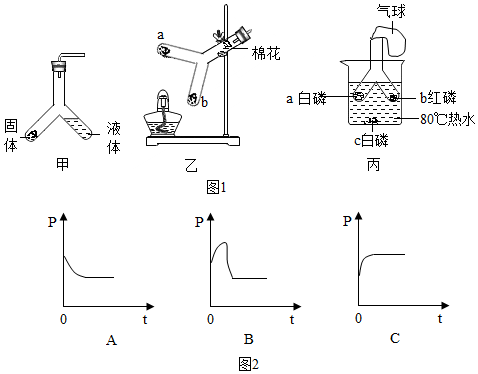
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
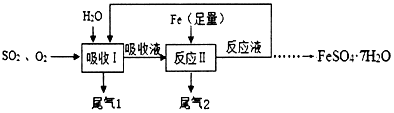
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
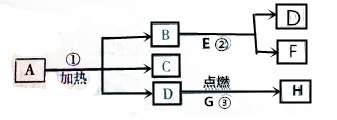 A.B…H八种物质,有下图所示关系:其中G是生活中常见的金属,在②的反应前后B的质量和化学性质都不改变,且E和F的组成元素相同.试判断:
A.B…H八种物质,有下图所示关系:其中G是生活中常见的金属,在②的反应前后B的质量和化学性质都不改变,且E和F的组成元素相同.试判断:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com