
| 矿石名称 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
| 溶解性 (20℃) | 阴离子 阳离子 | OH- | Cl- | CO |
| Cu2+ | 不 | 溶 | 不 | |
| 有关反应 | CuCO3?Cu(OH)2 2CuO+CO2↑+H2O 2CuO+CO2↑+H2O | |||
| CuCO3+2HCl=CuCl2+CO2↑+H2O | ||||
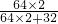 ×100%=80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%;
×100%=80%,但在辉铜矿中除了硫化亚铜还含有其他一些不含铜元素的杂质,故辉铜矿中铜的质量分数小于80%; 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑ =
=
 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O

 习题精选系列答案
习题精选系列答案科目:初中化学 来源: 题型:
| 矿石成分 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 矿石名称 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
| 溶解性 (20℃) |
阴离子 阳离子 |
OH- | Cl- | CO | ||||
| Cu2+ | 不 | 溶 | 不 | |||||
| 有关反应 | CuCO3?Cu(OH)2
| |||||||
| CuCO3+2HCl=CuCl2+CO2↑+H2O | ||||||||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 矿石成分 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
查看答案和解析>>
科目:初中化学 来源:2009年四川省成都市中考化学试卷(解析版) 题型:解答题
| 矿石成分 | 辉铜矿 | 孔雀石 | 黄铜矿 |
| 主要成分 | Cu2S | CuCO3?Cu(OH)2 | CuFeS2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com