
(10分)某兴趣小组分别向80.00 g 10%的NaOH溶液中加入体积不同、质量分数相同的盐酸,充分反应后,将所得溶液加热蒸发,直到固体完全析出且没有任何变化后,再研细、烘干、称量;重复将固体烘干、称量,直至称得的固体质量不再发生变化。实验测得,向80.00 g10%的NaOH溶液中加入80.00 mL盐酸时,溶液恰好呈中性,其它测得的部分数据则如下表所示: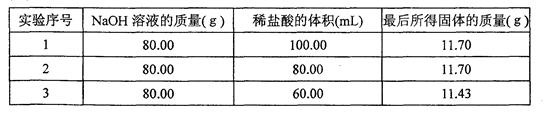
(1)加热蒸发所得溶液时需要用玻璃棒不断搅拌,其目的是: ;
(2)向80.00 g 10%NaOH溶液中加入盐酸的体积为100.00 mL时,最后所得固体的质量仍为11.70 g,其原因是: ,
(3)列式求出向80.00 g 10%NaOH溶液中加入40.00 mL盐酸时,最后所得固体中NaCl的质量分数(小数点后保留两位)。
(1)防止局部温度过高而使液体飞溅。
(2)当向80.00 g 10%NaOH溶液中加入盐酸的体积为100.00 mL时,虽然多加了20.00 mL稀盐酸,但并没有参与反应。当加热时,由于盐酸有挥发性,在加热时成为了气体,所以最后所得固体仍为11.70 g的氯化钠。om]
(3) 52.47%
解析试题分析:(1) 蒸发过程中必须用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅。
(2)根据题意可知:向80.00 g 10%NaOH溶液中加入盐酸的体积为80.00 mL时,二者恰好完全反应,最后所得固体氯化钠的质量为11.70 g,当向80.00 g 10%NaOH溶液中加入盐酸的体积为100.00 mL时,虽然多加了20.00 mL稀盐酸,但并没有参与反应。当加热时,由于盐酸有挥发性,在加热时成为了气体,所以最后所得固体仍为11.70 g的氯化钠。om]
(3)根据题意可知:当加入80.00 mL稀盐酸时,与80.00 g 10%NaOH溶液中的溶质8.00 g NaOH溶液恰好完全反应生成11.70 g氯化钠。
可知当加入40.00 mL盐酸时,所反应的氢氧化钠的质量为4.00 g,生成氯化钠的质量为5.85 g。
当加热时,剩余的4.00 g氢氧化钠与空气中的二氧化碳反应会生成碳酸钠。所以最后所得固体为氯化钠和碳酸钠的混合物。
已知量为4.00 g氢氧化钠;求知量为生成碳酸钠的质量。解题思路:可根据二者在化学方程式中的质量关系进行求解。具体过程如下:
设生成碳酸钠的质量为x,
2NaOH+CO2====Na2CO3+H2O
80 106
4.00 g x
80:106="4.00" g:x
x=5.30g
所得固体中NaCl的质量分数为: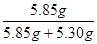 ×100%≈52.47%
×100%≈52.47%
答:所得固体中NaCl的质量分数为52.47%
考点:综合计算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:计算题
某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.
(1)反应中生成 g二氧化碳,此反应的基本反应类型为 ;
(2)通过计算说明实际钙含量是否与标注相符;
(3)试计算所用稀盐酸的溶质质量分数.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(12分)下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答: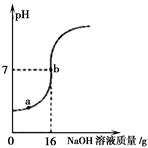
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(10分)市售珍珠粉的价格相差很大,但其外观、手感都没有明显差异,优质珍珠粉和廉价珍珠粉的成分有何不同呢?实验小组同学展开探究。
【查找资料】
①优质珍珠粉直接由贝科动物体内珍珠加工而成,含有一定量的氨基酸、碳酸钙等。
②廉价珍珠粉由“贝壳粉”加工而成,贝壳加工过程中会用到氢氧化钠,贝壳的主要成分是碳酸钙。
③珍珠粉中除碳酸钙外,其它成分均不能与盐酸反应生成二氧化碳。
④氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色。
⑤碳酸钙与浓硝酸能发生反应,生成二氧化碳。
⑥氯化钙溶液呈中性。
【提出猜想】优质珍珠粉和廉价珍珠粉的区别可能在于:
①廉价珍珠粉含有 ;
②廉价珍珠粉不含氨基酸;
③碳酸钙含量不同。
【实验探究】
| 实 验 内 容 | 现 象 | 结 论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 。 | 廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 | 猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,过滤, ,加热。 | 优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 | 猜想 成立 |
| | 优质珍珠粉 | 廉价珍珠粉 |
| 珍珠粉的质量 | 100g | 100g |
| 加入盐酸的质量 | 460.0g | 500g |
| 烧杯中最终物质的总质量 | 520.0g | 558.2g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某兴趣小组用10g镁条与溶质质量分数为49%的稀硫酸反应.测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其它杂质)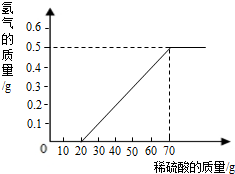
(1)当稀硫酸的质量为70g,产生的氢气的质量为0.5g
(2)用化学方程式说明当稀硫酸的质量为10g时,为什么不产生氢气 ;
(3)计算镁条中镁元素的质量分数(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
化学兴趣小组在化学实验室发现了一瓶已部分变质的氢氧化钠溶液,想测试它的变质情况。小组同学取10g该溶液放入烧杯中,然后将20g稀盐酸分4次加入同一个烧杯中充分反应,反应后称量质量。
变质的 分四次 每次反应后
NaOH溶液 加入稀盐酸 称量质量
实验过程的数据记录如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 稀盐酸的质量(g) | 5 | 5 | 5 | 5 |
| 反应后烧杯内物质的质量 | 15 | 19.56 | 24.12 | 29.12 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(8分)
某化学兴趣小组使用下图所示装置,对某种锌铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入15.0g合金样品开始计时,并将电子天平的读数记录在下表中,完成下列计算:
(1)反应完全后产生氢气的质量是多少?
(2)锌铜合金中铜的质量是多少?
(3)反应完全后溶液中溶质的质量分数是多少?
| | 空烧杯 | 加入硫酸后 | 加入合金后 5分钟 | 加入合金后 10分钟 | 加入合金后 30分钟 |
| 读数(g) | 21.3 | 169.7 | 184.6 | 184.3 | 184.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算: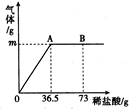
⑴A点产生气体的质量为 ;
⑵试样中碳酸钠的质量分数(结果精确到0.1%);
⑶B点时,烧杯内溶液中溶质的化学式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com