
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:阅读理解
| 验实号编 | 试剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 验实号编 | 试 剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 二氧化锰与氯酸钾的质量比 |
|
|
|
|
|
|
|
|
| ||||||||||||||||||
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
| 验实 号编 |
试剂 | 前 10min 内产生 的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源:2013年初中毕业升学考试(福建厦门卷)化学(解析版) 题型:探究题
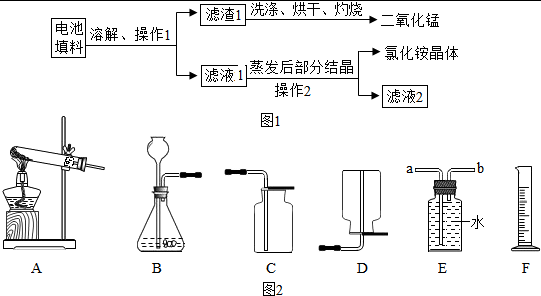
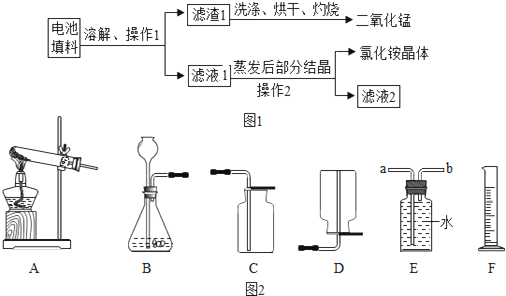
某化学兴趣小组回收利用废旧干电池。
实验 1 回收填料中的二氧化锰和氯化铵
查阅资料:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可于水。兴趣小组的同学们设计回收物质的流程如图 12 所示。

(1)操作1 和操作2 的名称都是____________,该操作中玻璃棒的作用是____________。
(2)灼烧滤渣 l 的目的是________________________ 。
(3)己知滤液 1 中氯化铵和氯化锌的浓度相近。在某温度下蒸发滤液1 时,大量的氯化铵晶体先析出,说明该温度下氯化铵溶解度____氯化锌的溶解度(填“<”、“=”或“>”)。
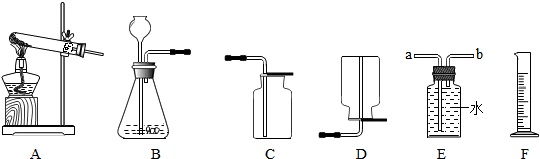
实验 2 利用外壳回收物锌制取氢气及相关探究
(4)用锌和稀硫酸制取氢气。己知氢气密度比空气小且难溶于水,提供装置如图 13 。
① 应选择:发生装置为____(填编号),排空气法收集装置为____(填编号)。
② 若用排水法收集并测定气体的体积,气体从装置 B 导管口____(填“ a ”或“ b ” ) 进;选用仪器 F 测量排出水的体积,仪器 F 名称是________。

(5)探究影响锌与稀硫酸反应快慢的因素。反应过程中,用前 10 min 内收集的氢气体积比较反应的快慢。控制其他条件相同,进行下表四组实验,获得数据如下表。
|
验实号编 |
试剂 |
前 10 min 内产生的氢气体积(mL) |
|
|
不同纯度的锌 |
不同体积和浓度的稀硫酸 |
||
|
a |
纯锌 |
30 mL 30 % |
564.3 |
|
b |
含杂质的锌 |
30 InL 30 % |
634.7 |
|
c |
纯锌 |
30 mL 20 % |
449.3 |
|
d |
纯锌 |
40 mL 30 % |
602.8 |
① 比较实验 a 和实验 b ,可以得到的结论是________________________。
② 为了研究硫酸浓度对反应快慢的影响,需比较实验_____和实验_____(填编号)。
③ 控制其他条件相同,需控制的条件是______________________(例举一种条件即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
 一、K2SO4的制备
一、K2SO4的制备
(1)将CaCO3研成粉末的目的是 ▲ 。
(2)上述流程中可循环使用的物质有CO2和 ▲ (填写化学式)。
(3)反应Ⅲ中相关物质的溶解度如下表。你认为反应Ⅲ在常温下能实现的原因是 ▲ 。
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ▲ ;为检验此晶体是否洗涤干净,可取最后 一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
一次洗涤液,先加入 ▲ (选填序号,下同),振荡、静置,再向上层清液中滴加 ▲ ,观察现象即可判断。
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(5)分离所得的CaSO4•2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 ▲ 。
 (6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用下图所示的装置(夹持仪器省略)进行实验。

 |
|
①实验前首先要 ▲ ,再装入样品。装置A的作用是 ▲ 。
②已知CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全。现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g

 某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。你认为还可选用上述的 ▲  (选填序号)两个数据组合也可求出x:y的值。
(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO4•2H2O受热会逐步失去结晶水。取纯
净CaSO4•2H2O固体3.44g,放在(5)的实
验装置B中进行加热,测定固体质量随温
度的变化情况如右图所示。
①G点固体的化学式是 ▲ 。
②将T2~1400℃温度段加热固体所产 生的
生的
气体
|
则H~I段发生反应的化学方程式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com