

分析 (1)根据常见的金属的活动性大小顺序分析缺少的金属即可:金属活动性顺序为:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au.
(2)根据铝的性质分析回答.
(3)根据金属与盐溶液的反应进行分析,在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,且置换时先把最弱的金属置换出来.
解答 解:(1)根据金属的活动性顺序,金属活动性顺序表中的X是Hg元素.
(2)铝的化学性质比较活泼,能和氧气反应生成一层致密的氧化物薄膜,从而对铝起到保护作用,该反应的化学方程式为:4Al+3O2═2Al2O3.
(3)在金属活动性顺序中,Zn>Fe>Ag,向一定质量AgNO3和Fe(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应
Zn+2AgNO3=Zn(NO3)2+2Ag
65 216
所以析出银的过程是溶液质量减少的过程;
Zn+Fe(NO3)2=Zn(NO3)2+Fe
65 56
所以析出铁的过程是溶液质量增加的过程
所以AB段发生反应的化学方程式为Zn+2AgNO3═Zn(NO3)2+2Ag;
B点时锌与AgNO3恰好完全反应,没有与Fe(NO3)2反应,此时溶液中含有Fe(NO3)2、Zn(NO3)2;
故答案为:(1)汞;
(2)4Al+3O2═2Al2O3;
(3)Zn+2AgNO3═Zn(NO3)2+2Ag;Zn(NO3)2、Fe(NO3)3.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义以及反应的实验现象进行.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 闻到花香说明分子在不停地做无规则运动 | |
| B. | 金刚石和石墨化学性质不同是因为他们的分子结构不同 | |
| C. | 固体很难被压缩是因为分子间存在斥力 | |
| D. | 原子是化学变化中的最小微粒 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | B. | H2CO3═CO2↑+H2O | ||
| C. | BaCl2+2AgNO3═2AgCl↓+Ba(NO3)2 | D. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②③⑤ | C. | ②④ | D. | ②⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
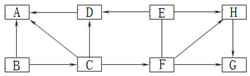
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
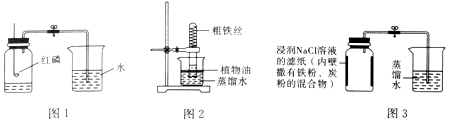
| 实验前的体积 | 实验后的体积 | |
| 集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
| 131mL | 90.0mL | 63.6mL |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 高铁酸钠由三种元素组成 | B. | 高铁酸钠中铁元素的化合价是+2价 | ||
| C. | 高铁酸钠是一种碱 | D. | 高铁酸钠中含有单质铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com