
【题目】(1)我国自主研发的龙芯CPU已经应用于包括北斗卫星在内的十几种国家重器中,芯片作为所有电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。用化学方法制高纯硅的反应原理为:

①2C+SiO22=CO↑+Si(粗硅)
②Si+2Cl2=SiC14(液态)
③2H2+SiCl44HC1+Si(高纯硅)
请回答下列问题:
①上述反应中,属于置换反应的是_________(填序号)。
②SiCl4中的硅元素的化合价是___________。
③反应①中有剧毒的CO生成,它能使人体缺氧而造成“煤气中毒”。如果发现有人CO中毒,你将采取什么措適?________________。
(2)中国的高铁运营里程居全世界第一,高铁技术日在世界范围内实现赶超甚至引领,成为中国的一张外交名片,结合所学知识,回答下列问题:
①铁路建设中大量使用了以下材料:石子、钢筋水泥柱 、钢轨等,其中钢轨属于__________。
A.金属材料 B.合成材料 C.有机天然材料 D.无机非金属材料
②建设中,常用铝和氧化铁(Fe2O3)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的隙进行焊接,反应的化学方程式为:Fe2O3+2A1X+2Fe,则X的化学式为__________。
③钢铁长时间使用后会生锈.铁锈的主要成分是Fe2O3:工业上最常用盐酸除去铁锈,请写出该反应的化学方程式:__________________________。
④在生活中铁比铝更容易被锈蚀,请分别说明其原因:___________________________。
【答案】 ① ③ +4价 开门窗通风,将中毒者移出中毒环境,给予吸氧或呼吸新鲜空气,同时要注意保暖;中毒严重者,送医治疗。(答案合理便可以给分) A Al2O3 Fe2O3+6HCl=2FeCl3+3H2O 铝跟氧气发生反应,生成致密而坚固的氧化铝薄膜,阻止进一步被氧化,从而起到保护作用;钢铁锈蚀生成铁锈疏松多孔,会把空气和水分保留在钢铁制品表面,进一步加速锈蚀。(合理答案酌情给分)
【解析】(1)①SiO2+2C═Si+2CO↑、SiCl4+2H2═Si+4HCl两个反应中反应物和生成物都是一种单质和一种化合物,属于置换反应,上述反应中,属于置换反应的是①③;②设SiCl4中硅的化合价为![]() ,根据化合物中正负化合价的代数和为0,
,根据化合物中正负化合价的代数和为0,![]() ,可知
,可知![]() =+4,所以SiCl4的硅元素的化合价是+4;③反应①中有剧毒的CO生成,它能使人体缺氧而造成“煤气中毒”。如果发现有人CO中毒,可采取的措施为:开门窗通风,将中毒者移出中毒环境,给予吸氧或呼吸新鲜空气,同时要注意保暖;中毒严重者,送医治疗;(2)①铁路建设中大量使用了以下材料:石子、钢筋水泥柱 、钢轨等,其中钢轨属于金属材料;②建设中,常用铝和氧化铁(Fe2O3)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的隙进行焊接,反应的化学方程式为:Fe2O3+2A1X+2Fe,根据化学反应前后原子的种类和数目不变,可知X的化学式为:Al2O3;③钢铁长时间使用后会生锈,铁锈的主要成分是Fe2O3,工业上最常用盐酸除去铁锈,盐酸和氧化铁反应生成氯化铁和水,反应的化学方程式:Fe2O3+6HCl=2FeCl3+3H2O;④在生活中铁比铝更容易被锈蚀,请分别说明其原因:铝跟氧气发生反应,生成致密而坚固的氧化铝薄膜,阻止进一步被氧化,从而起到保护作用;钢铁锈蚀生成铁锈疏松多孔,会把空气和水分保留在钢铁制品表面,进一步加速锈蚀。
=+4,所以SiCl4的硅元素的化合价是+4;③反应①中有剧毒的CO生成,它能使人体缺氧而造成“煤气中毒”。如果发现有人CO中毒,可采取的措施为:开门窗通风,将中毒者移出中毒环境,给予吸氧或呼吸新鲜空气,同时要注意保暖;中毒严重者,送医治疗;(2)①铁路建设中大量使用了以下材料:石子、钢筋水泥柱 、钢轨等,其中钢轨属于金属材料;②建设中,常用铝和氧化铁(Fe2O3)在高温条件下,反应生成熔融状态下的铁单质对钢轨中的隙进行焊接,反应的化学方程式为:Fe2O3+2A1X+2Fe,根据化学反应前后原子的种类和数目不变,可知X的化学式为:Al2O3;③钢铁长时间使用后会生锈,铁锈的主要成分是Fe2O3,工业上最常用盐酸除去铁锈,盐酸和氧化铁反应生成氯化铁和水,反应的化学方程式:Fe2O3+6HCl=2FeCl3+3H2O;④在生活中铁比铝更容易被锈蚀,请分别说明其原因:铝跟氧气发生反应,生成致密而坚固的氧化铝薄膜,阻止进一步被氧化,从而起到保护作用;钢铁锈蚀生成铁锈疏松多孔,会把空气和水分保留在钢铁制品表面,进一步加速锈蚀。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:初中化学 来源: 题型:
【题目】溶液在生活中应用非常广泛,因而了解溶液的有关知识非常必要。
(1)下图甲为X、Y、Z三种固体物质的溶解度曲线,根据曲线可知30oC时X的溶解度为_______g。小明同学欲在40oC时配制100g 25%的Y物质的溶液,他_______(填“能”或“不能”)达到目的。
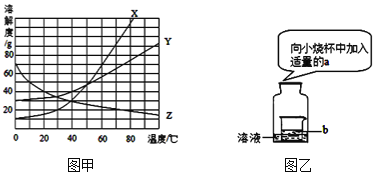
(2)小丽用图乙所示装置进行实验。
①若广口瓶内盛有70 g X物质的不饱和溶液, b是水,a是下列________(填字母)物质,有望变成饱和溶液。
A.浓硫酸 B.硝酸铵 C.氢氧化钠 D.氧化钙
②若广口瓶内盛有10gZ物质的饱和溶液,a、b分别是镁条和稀硫酸,观察到的现象是(Z与其他物质不反应)______________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究影响氯酸钾分解速率的因素,小红同学把实验温度恒定在330℃或380℃,(其他实验条件见下表),并设计了以下实验。
实验编号 | 氯酸钾的质量 | 其他物质的质量∕g | 温度∕℃ | 收集氧气的体积/mL | 反应所需时间∕s |
① | 2.0 | 330 | 100 | t1 | |
② | 2.0 | CuO 0.5 | 330 | 100 | t2 |
③ | 2.0 | MnO2 0.5 | 330 | 100 | t3 |
④ | 2.0 | MnO2 ____ | _______ | 100 | t4 |
请回答
(1)进行实验②和③,并对对比,其实验目的是____________________。
(2)要说明氧化铜对氯酸钾分解速率的影响,则要选用实验______和实验_______进行对比。
(3)用实验③和④探究温度对氯酸钾分解速率的影响,则MnO2的质量是__________g,反应的温度是_________℃,实验④发生反应的化学方程式为___________________;若t3>t4,氯酸钾分解速率与温度的关系是__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用如图所示装置进行实验,研究燃烧的条件.
已知:白磷的着火点为40℃,红磷的着火点为240℃.
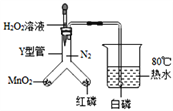
(1)当H2O2溶液与MnO2接触时,发生反应的化学方程式为_____________________.
(2)检查上述装置气密性的实验方案是________________________.
(3)向Y型管中挤入H2O2溶液后,观察到导管口开始产生气泡时,烧杯中白磷不燃烧;一段时间后,白磷燃烧,此现象能够证明的可燃物燃烧的条件是_____________________;Y型管中红磷不燃烧则说明可燃物燃烧的另一个条件是_____________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天平两端的烧杯中分别放有足量的等质量、等溶质质量分数的稀盐酸,调整天平到平衡后,向天平右边烧杯中加入2.8gCaO,若仍使天平最终保持平衡,应向左端的烧杯中加入碳酸钙的质量是
A. 2.8g B. 5g C. 3g D. 3.2g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸和碱是初中阶段两类非常重要的化合物。
(1)酸和碱之间能发生中和反应,该反应的实质是________________。
(2)实验考试时,需要用1%的氢氧化钠溶液100g,有关操作如图1所示:
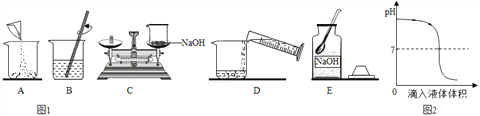
以上实验正确的操作顺序是_____(用字母代号表示);C操作中有明显的错误,正确的操作应该是______;量取一定体积的水时,需要选用的合适的仪器是_____。
(3)用pH试纸测定所配制的溶液的酸碱度,写出具体的操作方法。
(实验拓展)如图2是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。滴加顺序有两种,a是将氢氧化钠溶液滴入盐酸中,b是将盐酸滴入氢氧化钠溶液中。
根据曲线判断,该反应的滴加顺序是_______(填“a“或“b“)。某同学在滴加过程中,意外发现了有气泡产生,请解释原因_____(写一个即可)。
(实验反思)某已变质的氢氧化钠溶液100g,向其中加入溶质质量分数为7.3%的稀盐酸100g,恰好完全反应得到中性溶液。则蒸干该中性溶液可得到固体的质量是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A、B、C三种物质的溶解度曲线如图所示。
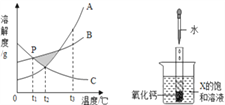
(1)在阴影区域部分,处于不饱和状态的是__________________。
(2)若饱和A溶液中含有少量的C,提纯A的方法为__________结晶,过滤。
(3)P点表示的含义为________________________________。
(4)在t1℃下,B、C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为___________。
(5)向试管中滴入2mL水后,若X中有固体析出,则X为___________ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验探究一:课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 | 实验现象 | 实验结论及解释 |
Ⅰ. | A中无明显现象, B中产生大量能使带火星木条复燃的气体 | ① 产生的气体是______ ② 红砖粉末能改变过氧化氢分解速率 |
Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 | ① 又产生大量能使带火星木条复燃的气体 ② 滤渣质量等于ag | 红砖粉末的_____在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
Ⅲ. | 两试管中均产生气泡且______ | 红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】
己知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气_____g。
实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。淅河中学化学学习小组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究。
【提出猜想】1.未变质 2.部分变质 3.完全变质
【查阅资料】KOH与NaOH性质类似,也能与CO2反应而变质。写出KOH变质的化学方程式为_____。
【设计实验】
(l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想_____不成立。
(2)准确称取一定质量的固体样品,放在右图所示装置中进行实验,根据CO2的体积和密度计算变质产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由_________。
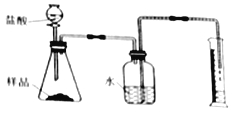
(3)请你另外设计一个方案,进一步探究变质情况
实验步骤 | 实验现象 | 实验结论 |
猜想2成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以钛铁矿(主要成分为 FeTiO3,同时含有少量的 Fe2O3、FeO等)为原料制 TiO2,再由 TiO2制金属 Ti 的工艺流程如下:
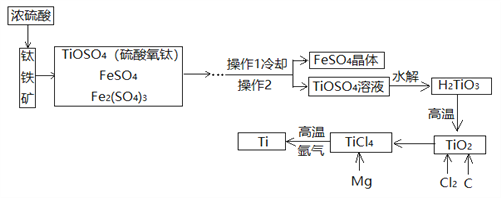
(查阅资料)①钛、镁在高温下与空气中的氧气、二氧化碳等反应。
②TiO2与氯气、焦炭在高温下按氯气和碳的质量比71:12参加反应。
下列说法错误的是
A. 生成硫酸铁的反应属于是置换反应
B. 操作2的名称是过滤;水解属于化学变化
C. 用金属镁和 TiCl4反应的方法制备Ti,氩气的作用是催化作用
D. TiO2与氯气、焦炭在高温下反应的化学方程式为:TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com