
分析 根据硫和氧气在点燃的条件下生成二氧化硫进行分析;
根据铁丝和氧气在点燃的条件下生成四氧化三铁进行分析;
根据过氧化氢在二氧化锰的催化作用下生成水和氧气进行分析;
根据高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气进行分析.
解答 解:硫和氧气在点燃的条件下生成二氧化硫,化学方程式为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,该反应属于化合反应;
铁丝和氧气在点燃的条件下生成四氧化三铁,化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,该反应属于化合反应;
过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应属于分解反应;
高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,该反应属于分解反应.
故答案为:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,化合反应;
3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4,化合反应;
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,分解反应;
2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,分解反应.
点评 在解此类题时,首先分析应用的原理,然后找出反应物、生成物,最后结合方程式的书写规则书写方程式.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. | |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验一 | 实验二 |
 | 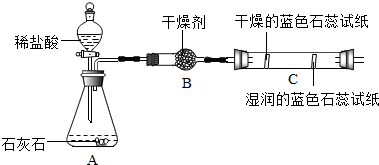 |
| 实验三 | 实验四 |
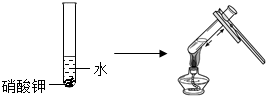 |  |
| 实验五 | |
 |  |
| 硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
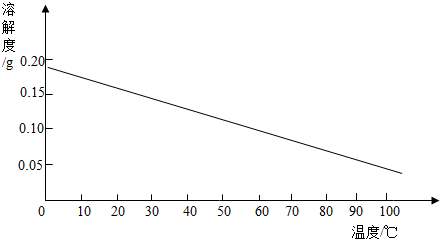
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.3mL蒸馏水 | |
| B. | 用托盘天平称取12.9gNaCl固体 | |
| C. | 向50mL小烧杯中倒入约30mL蒸馏水 | |
| D. | 用pH试纸(即广泛pH试纸)测得某盐酸的pH为2.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com